Évolution ou dévolution ?
Par Dominique Tassot
Présentation : La vision évolutionniste du monde vivant exerce, on ne le sait que trop, un quasi-monopole sur la pensée universitaire. Or ce château de cartes repose entièrement sur l’hypothèse que la sélection naturelle serait capable de trier entre les bonnes et les mauvaises mutations, ouvrant ainsi une fenêtre pour la multiplication des individus les plus aptes. Avec les connaissances, même très partielles, que nous avons désormais du génome, il devient clair que cette hypothèse est fausse. Nous sommes tous des mutants. Mais, d’une part, la dégénérescence par accumulation des mutations délétères échappe à la sélection car elle se produit à l’échelle moléculaire ; et, d’autre part, il est impossible d’éliminer les individus qui ne sont pas porteurs de l’éventuelle mutation positive sans éteindre démographiquement toute l’espèce. Accepter l’entropie du génome, c’est aussi modifier notre regard sur l’histoire tant passée que future de l’humanité.
Il est toujours dangereux de s’opposer pour se poser : la posture prise demeure de quelque manière liée – fût-ce par une négation – à l’objet rejeté. En 1943, lorsque Georges Salet et Louis Laffont publièrent leur mémorable livre sur L’Évolution régressive, le titre annonçait une réfutation de l’évolution progressive, la seule qui eût valeur philosophique ou idéologique. Ils y procédaient même par une double approche : scientifique et théologique ; mais en conservant le mot fantasmagorique d’évolution, ils donnaient encore, sans le vouloir, de l’importance au mythe centenaire.
Il ne faut jamais perdre de vue que, lorsque Lamarck et Darwin affirmèrent que les êtres vivants se transformaient – acquérant des organes ou des fonctions dont leurs ancêtres ne jouissaient pas –, les connaissances sur l’hérédité étaient rudimentaires, largement cantonnées aux animaux et plantes domestiques. L’étonnante «plasticité du vivant» [1] était connue, mais non mesurée. On était donc tenté de croire possible tout ce qui était vraisemblable ou même simplement souhaité.
En général, comparaison n’est pas raison : il faut se méfier des déductions menées sur la base d’une ressemblance.
Dans le cas du génome, toutefois, l’analogie entre les nucléotides (les échelons sur la double hélice de l’ADN) et les lettres d’un texte imprimé est si puissante qu’elle commande toute la biologie moléculaire. À première vue, il semble paradoxal que notre compréhension de la vie cellulaire et de ses processus fasse appel au vocabulaire de la science la plus immatérielle qui puisse se concevoir : la linguistique. Le langage est le propre de l’homme. Certes, il se réalise dans une empreinte matérielle – sonore, graphique ou gestuelle –, mais sa nature est tout autre, puisqu’il expose et même forge les opérations de la pensée ou les émotions de l’âme. Comment se peut-il donc que les mêmes mots abstraits, décrivant l’acte humain le plus subtil, soient repris aujourd’hui, à titre de vocabulaire technique, par la physiologie et la génétique ? On parlera ainsi de « lecture » (par le ribosome), de «transposition» (d’un fragment de gène), de «codage», d’information, de «message», de «déchiffrement», de «transcription», etc.
Un tel parallélisme aussi fin et aussi pertinent entre les deux domaines requiert notre méditation, car il fait écho à ce mystérieux verset du quatrième Évangile : « Au commencement était le Verbe. » Pour l’heure, nous nous contenterons d’utiliser pour les cellules d’un être vivant, mutatis mutandis, cette image que donne John Sanford dans son livre récemment traduit en français, L’Entropie génétique [2] :
«Le génome est un manuel qui fournit des instructions aux cellules humaines pour qu’elles soient des cellules humaines, et au corps humain pour qu’il soit un corps humain. […] Quand vous assemblez le petit chariot rouge que vous avez acheté pour votre enfant, il y a un livret qui vous indique comment le monter. La taille du livret est trompeuse. Elle ne contient pas toutes les informations requises pour fabriquer les éléments ni pour fabriquer l’acier, le caoutchouc et la peinture. Le manuel d’instruction complet serait en réalité un volume très important. Si vous compiliez tous les manuels d’instructions en lien avec la production d’une automobile moderne, le résultat remplirait une bibliothèque.
Cette bibliothèque serait même très grande si elle incluait l’information requise pour fabriquer tous les composants destinés à créer les robots des chaînes de montage» (L’entropie génétique, p. 15.)
Pour mesurer la taille et la complexité de ce «manuel», il faut savoir que le génome humain se compose de deux ensembles linéaires de 3 milliards de lettres, mais qui se lisent de multiples façons, avec des boucles et des branches qui le font ressembler à un programme informatique plus qu’à un seul livre continu. Des chapitres, les gènes, «régulent des gènes qui, eux-mêmes, régulent des gènes. [Le génome] possède des gènes qui détectent des changements dans l’environnement et qui demandent alors à d’autres gènes de réagir en mettant en mouvement toute une série de cascades complexes d’événements qui peuvent alors répondre adéquatement au signal donné. Certains gènes se réarrangent activement ou modifient et méthylent [3] d’autres séquences de gènes, changeant fondamentalement des parties du manuel d’instruction !» (EG, p. 17.)
La question se pose alors : d’où vient cette prodigieuse information (dont la subtilité et la compacité nous émerveillent) et comment peut-elle subsister ? Depuis près d’un siècle, la réponse conventionnelle, à laquelle doit souscrire tout universitaire ou tout chercheur dans un établissement public, est la suivante : ce sont les mutations et la sélection naturelle qui ont créé toute cette information biologique. Ou encore, plus précisément : «la vie est la vie parce que des mutations aléatoires au niveau moléculaire sont filtrées à l’aide d’un tamis reproductif qui agit au niveau de l’organisme dans son ensemble» (EG, p. 18.)
Or ces mutations, aléatoires, sont les erreurs de copie intervenues lors de la reproduction. Chaque nouveau petit chariot sort ainsi de la chaîne avec son manuel modifié et c’est ce nouveau manuel qui va servir pour l’assemblage du chariot suivant. Les anciens manuels, plus proches de l’original, ont disparu dans la nature avec leur chariot.
Au fil du temps, les erreurs s’accumulent donc dans les manuels et, du fait de l’information perdue, les instructions se dégradent et la qualité du chariot se détériore. C’est l’entropie génétique, analogue au refroidissement naturel d’un plat chaud (entropie thermique.)
Est-il vraiment possible que la sélection naturelle puisse évincer ce phénomène, voire même repérer et ajouter des informations utiles, capable de perfectionner notre petit chariot ? C’est du moins ce qu’affirment et croient la plupart des généticiens, influencés depuis un siècle par les modèles mathématiques complexes qu’élabore la génétique des populations.
Pourtant, les faits observés quotidiennement dans les laboratoires comme dans la nature prêchent l’inverse : la loi du vivant, du moins telle que nous commençons à la comprendre depuis la découverte de l’ADN en 1953, est la dégénérescence, la dévolution, pas l’évolution (progressive.)
Nous avions rencontré ce mot inhabituel de dévolution en 2006, lors d’une audition au Parlement européen sur «l’enseignement de l’évolution dans les écoles européennes». Quatre intervenants y étaient au programme : Guy Berthault (pour la sédimentologie), Hans-Joachim Zillmer [4] (pour la paléontologie), le Pr Joseph Mastropaolo (pour la biologie) et Maciej Giertych, lui-même député européen, (pour la génétique). Spécialiste de médecine spatiale, de la physiologie de ceux qui vivent en apesanteur, le Pr Mastropaolo avait montré comment le nombre de maladies nouvelles, souvent liées au génome, augmentait de façon exponentielle et faisait craindre pour la survie à long terme de l’espèce humaine : c’était donc la « dévolution » qu’il constatait, l’affaiblissement graduel de notre vitalité et de notre vigueur héréditaire, la dégénérescence.
Or cette dévolution [5] actuelle, bien visible, est l’exact opposé de l’évolution progressive partout enseignée comme la grande loi du vivant.
Comment était-il donc possible que la thèse d’une évolution complexifiante eût pu se maintenir depuis des décennies, si les faits pointaient dans l’autre sens ?
La réponse nous est apportée par John Sanford. Éminent généticien [6], il ne s’est dégagé du filet évolutionniste que depuis une dizaine d’années, au terme d’un long combat intérieur, tant moral qu’intellectuel. Le nœud de la question est que la solution avancée par les néodarwiniens (avec l’action du couple mutations/sélection) semble simple et évidente : les mutations délétères (le négatif) seraient surcompensées par la sélection naturelle (le positif.) Même si les mutations avantageuses sont rares, ce sont donc elles qui finissent par se fixer dans le génome. Qui pourrait contester que le «plus apte» est bel et bien avantagé et donc l’emportera !
Discipline nouvelle, apparue vers 1920, la génétique des populations s’est élaborée pour le démontrer grâce à des modèles mathématiques que seuls les spécialistes savent manier. Ainsi, la plupart des généticiens peuvent-ils continuer de croire au mythe de l’évolution progressive : la charge de la preuve est assumée par de savants collègues faisant autorité.
Or il s’est passé au XXe siècle, pour les théories statistiques sur la sélection naturelle, le même phénomène de «pensée magique [7]» qu’au XIXe pour les théories transformistes : on croit volontiers ce qu’on souhaite et l’esprit critique s’émousse. Lamarck et Darwin parlaient de transformisme héréditaire sans en connaître les processus (la génétique n’existait pas.) Fischer et Haldane tablèrent sur les mutations sans connaître encore la nature fine du génome et les processus réels englobés sous ce nom magique de «mutation».
Dans la langue courante, «mutation» désigne en effet un changement rapide et visible. À l’échelle moléculaire du génome, en revanche, les mutations sont surtout des permutations, redoublements ou élisions de «lettres» n’ayant que rarement un effet direct sur le «phénome», sur l’apparence des êtres vivants. On croyait aussi que, comme souvent, les mutations allaient se répartir selon une classique courbe de Gauss, avec une symétrie entre mutations favorables et mutations défavorables.
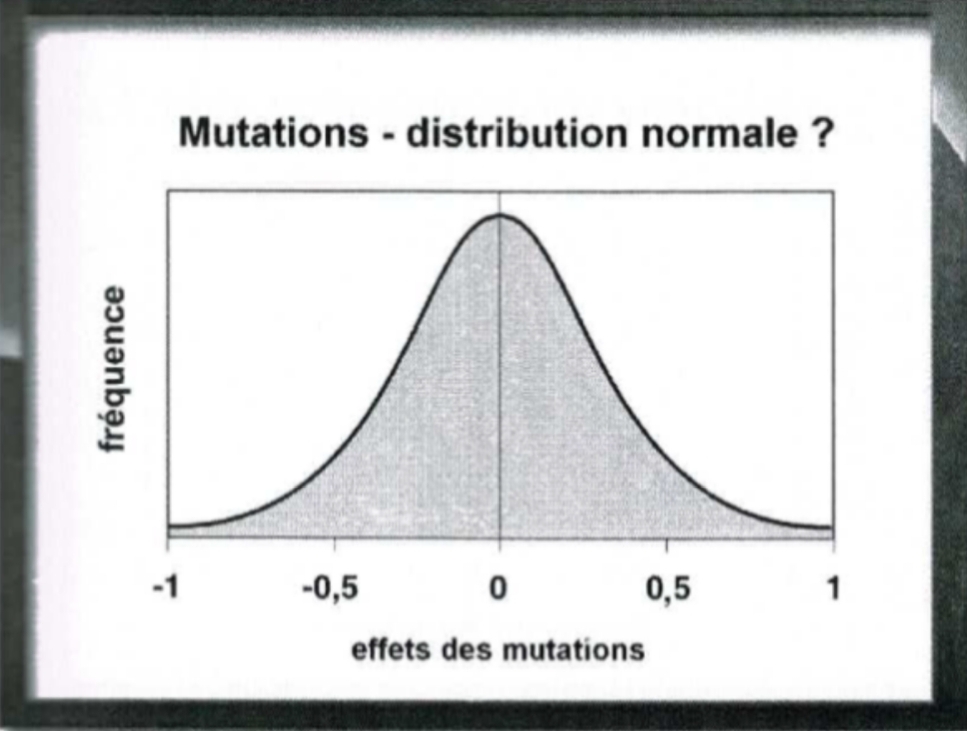
Fig. 1. Fréquence des mutations selon leur effet supposé. N. B. : effet variant de -1 à +1. (EG, p. 41).
Mais la mutation se comporte en réalité comme une faute de frappe dans la composition d’un texte. Une lettre manquante ou redoublée ne rend pas le mot de la phrase illisible : il faut pour cela que les fautes s’accumulent ! Inversement, la probabilité pour qu’un mot altéré retrouve un sens intelligible est faible, voire infime, mais elle existe. Ainsi de «truc» à «troc» ou de «film» à «fils». Il a donc fallu revoir la courbe statistique des mutations, concentrer les altérations vers le centre (les petites fautes sans impact majeur) et aplatir – au point de la faire se confondre avec l’axe horizontal – la courbe de fréquence des mutations positives.
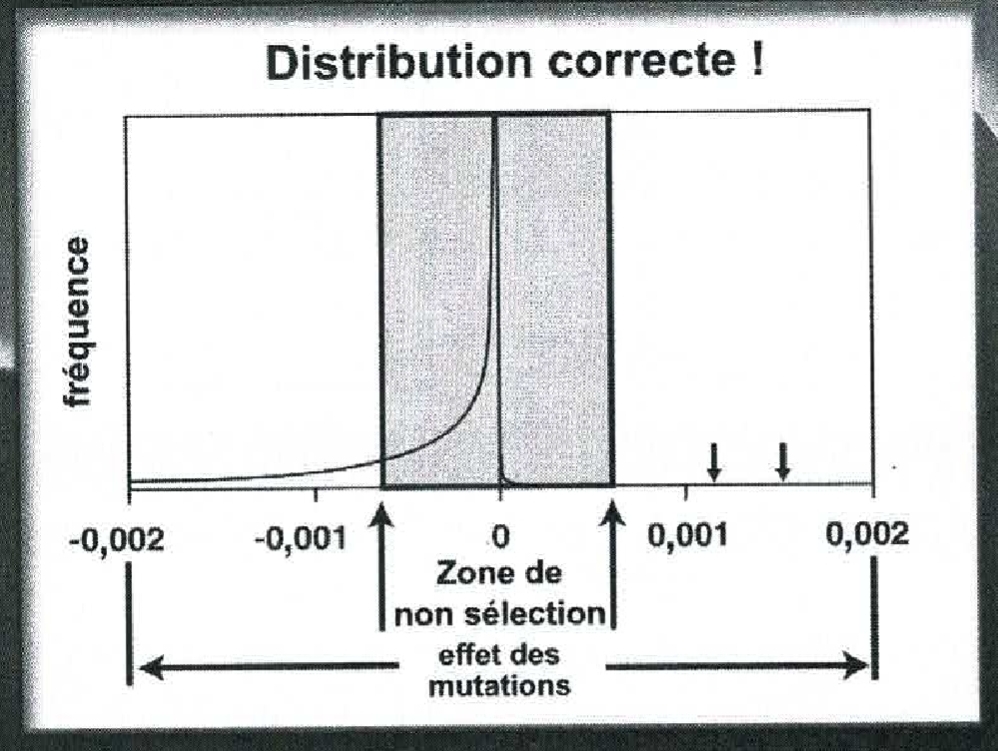
Fig. 2. Distribution réaliste des mutations selon leur effet. N. B. : l’échelle, sur l’axe horizontal, a grossi 500 fois ! (EG, p. 44).
Il faut bien noter, sur la Figure 2 pourtant tracée à une échelle 500 fois plus grande que la Figure 1, que la courbe des mutations positives est à peine visible, se réduisant à un léger arrondi au pied de la verticale centrale. Elle se confond, pour le reste, avec l’axe horizontal. Les mutations dites «positives» sont donc si rares qu’il est impossbile de leur tracer une courbe sortant de la «boîte de Kimura», la zone centrale en grisé, dans laquelle les mutations sont neutres (invisibles pour la sélection.) De là les deux petites flèches, signalant, à titre d’exemple, la manière dont on pourrait représenter des événements ponctuels consistant en une mutation favorable ayant un effet sélectif.
Ayant ainsi ramené les mythiques mutations et leur valeur sélective à de plus justes proportions, il est temps pour nous de regarder de l’autre côté du couple néodarwinien : la sélection. Comment peut-elle opérer, au juste ? Comment l’avantage génomique survenu chez un individu va-t-il s’imposer à toute la population ?
Le «contrôleur» en bout de chaîne, c’est-à-dire la sélection naturelle, élimine les individus les moins aptes : il regarde donc le «phénome» (le chariot achevé) et non le génome (le manuel d’instruction.) Il n’opère donc pas directement sur l’une ou l’autre des mutations qui se produisent à l’échelle moléculaire, mutations n‘ayant, le plus souvent, aucune répercussion clairement visible. Notre «contrôleur» ne peut isoler la mutation favorable des autres mutations qui ont affecté le même individu. Il ne peut pas plus écarter les tares accumulées ni les effets du vieillissement, ni les mutations neutres ou quasi neutres (que John Sanford compare à la rouille sur un véhicule) qui n’ont pas de répercussions majeures immédiatement visibles.
Si même, par chance, un organe nouveau était apparu – par exemple un frein sur le chariot –, il serait éliminé comme non conforme au manuel de la génération antérieure.
Il y a ici un point majeur que les généticiens de la première moitié du XXe siècle ne pouvaient deviner, puisqu’ils ignoraient que les mutations se produisent à une échelle infinitésimale.
John Sanford évoque ici le conte bien connu d’Andersen dans lequel la jeune fille se révèle être une vraie princesse parce qu’un petit pois logé sous vingt matelas l’a empêchée de dormir.
La plupart des erreurs de «lettres» que sont les mutations deviennent imperceptibles à l’échelle de l’organisme entier, la disproportion étant même des milliers de fois plus grande que dans le conte d’Andersen.

Fig. 3. Les mutations moléculaires (figurées par les petits pois) et leur détection par l’observateur (la sélection) (EG, p. 76.)
Ce fait fut cependant reconnu en 1979 par un des grands noms de la génétique des populations, Kimura, qui écarta de la sélection les mutations de faible valeur, soit leur immense majorité (voir, en grisé, la « zone de non-sélection » sur la Figure 2.) Mais les conséquences n’ont pas été prises en compte : on a continué de présupposer que suffisamment de très rares mutations positives sortiraient de la «boîte de Kimura» et seraient repérées par la sélection (les petites flèches sur la droite de la Figure 2.) Là encore, ce n’était qu’une hypothèse onirique.
Car une seconde considération décisive concerne le «coût démographique» de la sélection. Dans les expériences de laboratoire, faites sur des espèces dont la fécondité est prodigieuse (une plante peut porter des dizaines de milliers de graines), il est possible d’écarter 99 % d’une génération et de ne retenir que le 1 % jugé le plus apte, ayant la meilleure «valeur sélective» (la meilleure fitness, en anglais.)
Pour des espèces telles que les mammifères, le taux d’élimination ne peut être aussi élevé : la sélection ferait disparaître l’espèce, alors que la théorie veut que le «plus apte» ait une fécondité supérieure. C’est le «dilemme de Haldane» (EG, p. 186.)
Chacun de nous ajoute environ 100 mutations au patrimoine génétique humain, lesquelles s’ajoutent aux milliers de mutations héritées de nos ancêtres. Or la sélection ne porte pas sur des nucléotides isolés, mais sur de grands blocs de liaison (100 000 à 200 000 chez l’homme) qui vont donc contenir, outre la mutation favorable, de nombreuses mutations délétères. Qui plus est, de multiples autres causes agissent sur la fécondité réelle d’un individu, liées à son histoire, à la chance ou à l’environnement. L’idée que, dans la nature, avec les taux de fécondité connus, la descendance d’un mutant favorisé puisse éliminer les autres génomes sans réduire la population de son espèce est hautement invraisemblable.
Comme pour les performances d’éleveurs dont Darwin s’était inspiré, une sélection «positive» ne peut être obtenue qu’artificiellement et en vue d’avantages ponctuels pour l’homme, non pour l’espèce.
Même chez les espèces végétales, où le génome est très long et mute facilement, la mutagenèse a été abandonnée comme méthode d’amélioration des plantes. Les seuls résultats «positifs» ont concerné des plantes décoratives sur lesquelles des effets étranges de forme ou de couleur ont été obtenus.
Il résulte de tout cela que la «charge génétique» (les tares héréditaires) augmente à chaque génération : c’est le «cliquet de Müller» (1964) (EG, p. 188.)
Mais Müller, ignorant les blocs de liaison, pensait encore que des mutations positives pourraient être sélectionnées individuellement. Il est désormais reconnu que la valeur sélective décroît inexorablement avec le temps.
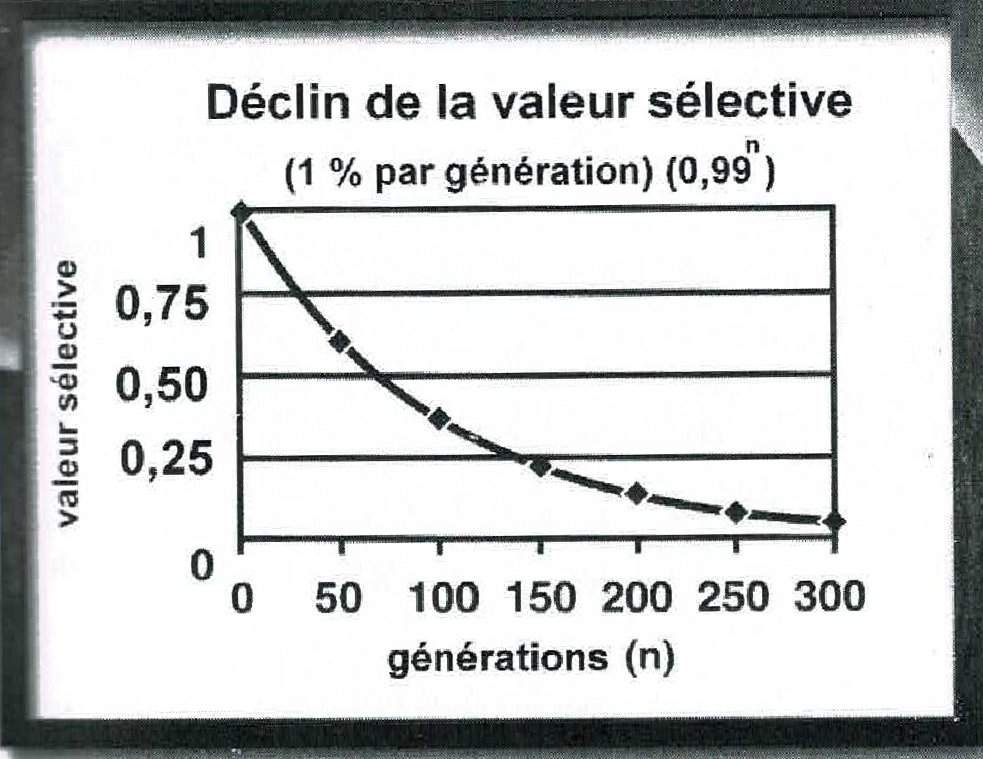
Fig. 4. La décroissance de la valeur sélective, de génération en génération (EG, p. 75.) Noter l’impact immédiat sur la longévité programmée pour l’humanité, du moins depuis le Déluge.
Pour qu’une mutation favorable affecte l’espèce, il faudrait qu’elle se généralise, que les non-porteurs soient éliminés.
Ce sont là des circonstances si irréalistes que les évolutionnistes conviennent que même les durées géologiques admises sont bien en deçà du compte (ainsi Haldane, EG, p. 187.)
Maigre consolation : il en va de même pour les virus ; si bien que les épidémies finissent par s’éteindre d’elles-mêmes. Ainsi la morbidité chez l’homme de la grippe H1N1 (qui, sous le nom de «grippe espagnole», fit plus de victimes que la guerre de 1914) était-elle devenue nulle au moment où fut déclenchée la panique vaccinaliste de 2009 (cf. Fig. 5.)
Ainsi la rareté des mutations sélectionnables et positives, jointe au coût démographique de la sélection, réduisent à néant le mythe d’une évolution progressive qui serait une loi générale de la vie.
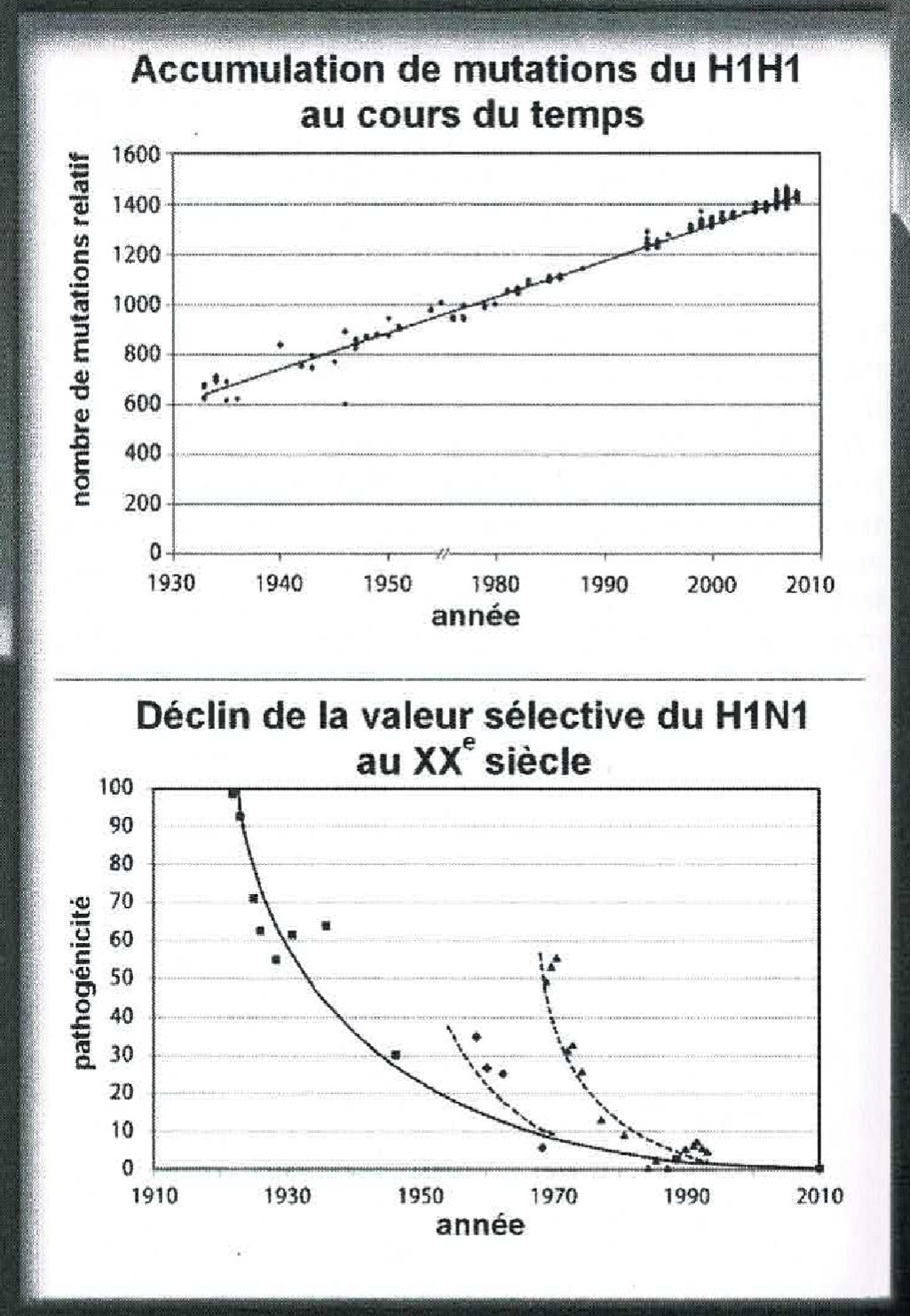
Fig. 5. Morbidité du virus H1N1 depuis 1918. N. B. : Courbe de déclin en traits pleins ; les courbes en pointillés concernent le H2N2 et le H3N2. (EG, p. 160.)
En revanche, c’est la dévolution, la dégénérescence, qui s’impose désormais, grâce à l’analyse fine des génomes au long des générations. La plupart d’entre nous sommes déjà incapables de vivre sans lunettes ou sans des éléments de confort inconnus de nos ancêtres. Compte tenu de cette entropie génétique croissante et d’un environnement physique et chimique de plus en plus mutagène, il est clair que la tendance se poursuit.
L’histoire de l’humanité ne se mesurera pas en milliers, mais en centaines de générations seulement. Est-ce une mauvaise nouvelle ? Oui, certainement, pour ceux qui ont fondé leur vision du monde sur la théorie transformiste. Non pour nous dont l’espérance regarde vers un autre monde.
Notes :
[1] Le mot est d’Agassiz, spécialiste des poissons fossiles, membre fondateur de l’Académie des sciences américaine et adversaire connu de Darwin.
[2] J. C. SANFORD, L’Entropie génétique et le mystère du génome, Le Séquestre, Éd. La Lumière, 2019, 264 p., 24 €, ici désigné dans le texte par l’abbréviation EG. Il peut être acquis sur : bibleetsciencediffusion.org.
[3] La méthylation est une modification chimique, très courante en biologie, consistant en l’ajout d’un groupe méthyle (CH3) à un substrat. L’ADN peut être méthylé au niveau des cytosines (la lettre C parmi les quatres «codons» A, T, G et C qui « écrivent » l’ADN.)
[4] Connu pour son livre Darwins Irrtum (L’Erreur de Darwin), traduit en 9 langues.
[5] En français, le mot «dévolution» est surtout employé au sens juridique d’une transmission successorale. Ainsi la «guerre de Dévolution» menée par Louis XIV. En anglais, le sens biologique de «dégénérescence» est déjà d’usage courant. Nous emploierons ici indifféremment l’un ou l’autre mot : dévolution ou dégénérescence.
[6] Connu en particulier comme l’inventeur du «canon à gènes», ce dispositif utilisé pour introduire des portions d’ADN dans le génome d’une cellule cible.
[7] «Wishful thinking» disent élégamment les Anglais.
Source : Le Cep, n° 89.
A propos de l’auteur

Dominique Tassot
Dominique Tassor est ingénieur civil des Mines (Paris 1967-1970), docteur en philosophie (Paris-Sorbonne 1994), ancien directeur R&D dans l’industrie pharmaceutique, et président du CEP (Centre d’Études et de Prospective sur la science.)
Quel bel article ! Bien rédigé. Dominique TASSOT est un vulgarisateur hors pair. C’est un excellent résumé du livre de John SANFORD que je viens de lire. Les concepts de la génétique des populations sont un peu abscons pour le commun des mortels. Ici, ils deviennent (presque) limpides !
Un seul bémol pour moi : l’illustration de la loi d’entropie par l’eau chaude qui refroidit… J’ai pas tout compris.
Bravo.