Dissection du darwinisme
(B&SD) : L’article ci-dessous du Dr Joseph Kuhn publié dans les Actes du Centre médical de l’Université de Baylor en 2012 constitue l’une des critiques scientifiques les plus synthétiques et les plus à jour qui aient jamais été publiées dans des Actes scientifiques dans un contexte séculier. A la lumière des connaissances modernes et actualisées, l’auteur décrit quelques unes des failles béantes du néodarwinisme mises en lumière par ailleurs par bien d’autres scientifiques avant lui ou après lui, et reprend des arguments scientifiques qui sont familiers aux scientifiques créationnistes (cf. par exemple, cet article montrant que l’évolution est une théorie invalidée par les faits), arguments qui, dans le monde anglophone, ont fissuré l’édifice du néodarwinisme, mais restent inconnus dans le monde francophone toujours aussi dogmatiquement et aveuglément attaché à l’évolution darwinienne. Pourtant, dès les débuts de la théorie darwinienne de l’évolution, des sommités scientifiques se sont opposées à cette dernière. Ce fut le cas, par exemple, de Jean Louis Agassiz (1807-1873), professeur de zoologie qui est considéré comme l’un des plus grands scientifiques du XIXe siècle et qui a été le père fondateur de l’établissement scientifique américain moderne et cofondateur de l’Académie américaine des sciences en 1863. Le Français Georges Cuvier (1769 – 1832) qui était admiré comme le meilleur anatomiste de son temps, l’un des fondateurs de l’anatomie comparée et un contributeur majeur au développement du Muséum National d’Histoire Naturelle de Paris, était également un créationniste convaincu.
En 1956, trois ans avant le centenaire du fameux livre de Darwin, le biologiste-en-chef du Commonwealth, William R. Thompson, avait écrit une Introduction remarquable à la version usuelle de l’Origine des espèces, dans laquelle il présentait une critique méthodique et radicale des principales affirmations de Darwin, et attribuait au darwinisme l’évanescence de la vision chrétienne du monde.
Plus proche de nous, le professeur Philip S. Skell, membre de l’Académie nationale américaine des sciences avait écrit, en 2010, une lettre ouverte au Conseil de l’éducation de l’Etat du Kansas, dans laquelle il déplorait le manque de liberté intellectuelle et d’honnêteté en science face à la théorie de l’évolution. En France, le mathématicien Marcel-Paul Schützenberger, membre de l’Académie des sciences, avait également, dans une interview publiée dans La Recherche en 1996, indiqué, de manière appuyée et claire, les failles du darwinisme. Mais depuis, l’opacité des milieux scientifiques français face aux critiques de l’évolution a été totale, malgré pourtant la tradition antidarwinienne de la France. On nous martèle que l’évolution est un fait dont la remise en question reviendrait à adopter la posture de celui qui croit que la Terre est plate. Aucun doute n’est permis à ce sujet. Le contraste est on ne peut plus marqué avec le monde anglophone où, en dépit de la résistance farouche de l’établissement, des critiques scientifiques de haut niveau sont formulées, voire même publiées dans des revues à comité de lecture ou dans des ouvrages universitaires. Le chimiste James Tour, mondialement réputé, a lancé un défi aux scientifiques évolutionnistes concernant l’hypothèse d’une origine naturaliste de la vie. Il fait partie d’un groupe croissant d’éminents scientifiques qui réfutent l’évolution. Pour le physiologiste non chrétien Denis Noble, la dissidence antidarwinienne a ainsi franchi un “point de basculement”. Le lecteur intéressé par le sujet pourra prendre connaissance des dix principaux problèmes scientifiques liés à l’évolution biologique et chimique. C’est avec plaisir que nous recommandons la lecture de l’article rafraîchissant du Dr Joseph Kuhn, médecin chirurgiste.
Par Joseph A. Kuhn, M.D.
John Hunter, le célèbre « père de la chirurgie scientifique », a compris l’anatomie humaine grâce à un processus de dissection minutieux. De 1750 à 1793, il a révolutionné l’anatomie chirurgicale moderne en disséquant des milliers d’échantillons humains dérivés de cadavres humains frais, provenant de tombes fraîches (1). On lui attribue la formation de plus de 2 000 chirurgiens dans le monde, fondée sur la doctrine de l’observation, de l’expérimentation et de l’application de preuves scientifiques, plutôt que sur le recours à des potions, des humeurs et des superstitions pour traiter les maladies. Parmi les premiers chirurgiens américains qui ont suivi ces cours d’anatomie très prisés, citons Philip Syng Physick, William Shippen, John Morgan et bien d’autres, qui ont contribué à jeter les bases de l’enseignement médical américain.
John Hunter était également un brillant biologiste et naturaliste, ayant disséqué et conservé des milliers d’animaux et de plantes. Ses échantillons considérables représentaient la totalité de l’exposition initiale du Royal College of Surgeons Museum. Dans deux longs volumes, intitulés Essays and Observations on Natural History, Anatomy, Physiology, Psychology, and Geology (Essais et observations sur l’histoire naturelle, l’anatomie, la physiologie, la psychologie et la géologie), il a mis en évidence la remarquable similitude des muscles et des organes entre les différentes espèces. John Hunter a proposé une formation progressive des espèces par mutation 70 ans avant que Charles Darwin ne publie ses observations dans De l’origine des espèces. L’histoire révèle donc que les chirurgiens sont particulièrement aptes à recueillir des informations, à faire des observations et à tirer des conclusions sur les découvertes scientifiques.
Alors que la communauté scientifique est confrontée à de nouvelles remises en question des conclusions traditionnelles concernant l’origine des espèces, l’origine de l’homme et l’évolution, il convient de disséquer ce nouveau corpus d’informations en faisant preuve d’équité et en s’appuyant sur des connaissances modernes. L’objectif de cet article est donc de passer en revue les arguments qui ont été avancés contre le concept d’évolution proposé par Charles Darwin et John Hunter, chirurgien et biologiste hors pair.
Étant donné que cette analyse est proposée par un médecin et chirurgien, il pourrait être approprié d’apporter des preuves de qualification et de crédibilité pour une telle entreprise scientifique. La médecine est un domaine qui attire certains des esprits les plus brillants, sur la base des résultats obtenus aux examens et des résultats obtenus au cours des études de premier cycle. La formation prémédicale moderne comprend généralement une licence en biologie, chimie, mathématiques, biochimie ou biologie moléculaire. La formation médicale comprend deux années d’enseignement des sciences fondamentales en biologie moléculaire, biochimie, biologie, anatomie, physiologie et pharmacologie, entre autres. La participation à la recherche clinique ou fondamentale est fréquente au cours de la formation médicale ou de l’internat. Les médecins poursuivent ensuite leur formation par l’application pratique des sciences fondamentales dans des situations de résolution de problèmes liés au corps humain. En ce qui concerne le corps humain, les médecins ont également une connaissance intime et intégrée de l’ensemble des interdépendances, de la biochimie et des processus moléculaires qui interviennent dans les différents systèmes. En fait, le médecin est l’avant-dernier expert des voies moléculaires appliquées aux conditions humaines. De nombreux chirurgiens, dont l’auteur, sont activement impliqués dans la thérapie génique, la vaccinothérapie et la technique de ciblage moléculaire la plus récente s’appuyant sur les incroyables percées dans notre compréhension de la science de l’ADN (2-4). Le médecin est donc une excellente source pour disséquer l’évolution sur la base de la science moderne et de la médecine appliquée.
Dans une enquête réalisée en 2005 auprès de 1472 médecins, près de 78 % d’entre eux étaient favorables à la croyance à l’évolution en tant qu’explication de l’origine des espèces (5). Parmi les scientifiques et les biologistes du pays, 99 % croient à l’évolution darwinienne (6). La définition de l’évolution a changé au fil des ans. Toutefois, les principes de base de Charles Darwin suggèrent que des mutations aléatoires se produisent et que la sélection naturelle agit continuellement sur la mutation survivante, ce qui conduit à de légères améliorations et à des changements dans les espèces au fil du temps. Le néodarwinisme a été inventé en 1895 et reflétait les connaissances en matière de reproduction et de recombinaison, conduisant à des changements potentiellement plus importants au sein des espèces. La « synthèse moderne » de la pensée évolutionniste a été proposée en 1950 pour intégrer les connaissances de la génétique, de la systématique, de la paléontologie et d’autres disciplines. Pris ensemble, les concepts de base reconnaissent que des mutations aléatoires se produisent et que la sélection naturelle agit continuellement sur la mutation survivante, conduisant à des améliorations et à des changements dans les espèces au fil du temps. Ces mutations peuvent se produire progressivement ou rapidement, selon un terme appelé saltation ou évolution ponctuée. Ce processus de mutations et de sélection naturelle a été proposé pour expliquer la descendance à partir d’un ancêtre commun, en remontant même jusqu’aux procaryotes originels qui ont vécu il y a des milliards d’années. Sur la base de la sélection naturelle et du temps, il a été théorisé que les organismes unicellulaires ont pu naître d’un mélange primordial d’éléments anciens et d’énergie.
Plusieurs organisations universitaires ont élaboré des lignes directrices visant à promouvoir l’évolution darwinienne (y compris le néodarwinisme, la synthèse moderne et l’évolution saltatoire) en tant que principe de base unique à enseigner dans les lycées, les universités et les établissements d’enseignement supérieur (7). Les systèmes scolaires ont débattu des mérites éducatifs de l’évolution darwinienne et se sont retrouvés devant divers tribunaux étatiques et fédéraux. Dans l’affaire Kitzmiller c. the Dover Area School District, le tribunal de district américain a statué en 2005, entre autres, que le Conseil de l’école ne pouvait pas exiger des enseignants qu’ils dénigrent ou déprécient la théorie scientifique de l’évolution (8). En 2010, le Conseil de l’éducation de l’État du Texas a accepté pendant trois jours des témoignages de scientifiques et de citoyens concernant l’enseignement de l’évolution. Des représentants du National Center for Science Education ont déclaré que l’enseignement des faiblesses de l’évolution marquerait injustement les futurs élèves de terminale comme étant mal préparés à postuler pour des postes universitaires sur la base d’une éducation qui pourrait être considérée comme non scientifique (9). Cependant, de nombreux autres scientifiques, citoyens et éducateurs ont apporté des preuves soulignant les faiblesses de l’évolution darwinienne. En fin de compte, le Conseil a adopté une position controversée et a voté pour que les futurs manuels scolaires de l’État expliquent les faiblesses et les forces de l’évolution darwinienne.
Deux points forts de l’évolution darwinienne sont généralement reconnus :
- Les espèces s’adaptent à un changement environnemental (changement de bec des oiseaux, résistance bactérienne, expériences sur les drosophiles). C’est ce que l’on appelle la microévolution.
- L’ADN présente des similitudes entre les espèces (l’on parle d’homologie).
Au cours des témoignages apportés lors du Conseil de l’éducation de l’Etat de Texas, trois questions ont été soulevées :
- Les limites des données sur l’origine chimique de la vie pour expliquer l’origine de l’ADN,
- Les limites des théories des mutations et de la sélection naturelle pour aborder la complexité irréductible de la cellule,
- Les limites des données sur les espèces de transition pour rendre compte de la multitude de changements qui se sont produits dans les transitions.
Dans les sections ci-dessous, je discute de ces trois faiblesses et je présente ensuite quelques réflexions finales sur le changement de paradigme.
L’origine chimique de la vie
En 1953, la discipline de l’abiogenèse a fait un grand pas en avant lorsque Stanley Miller et Harold Urey ont rapporté qu’une collection de cinq acides aminés simples pouvait être formée en plaçant une combinaison de produits chimiques dans un bocal et en soumettant le bocal à de l’énergie sous forme d’électricité (10, 11). Cette expérience continue d’être utilisée dans les manuels scolaires et universitaires comme l’explication fondamentale incontestée de l’origine de la vie basée sur un processus purement naturel (12). Malheureusement, les conditions expérimentales d’un environnement réducteur pauvre en oxygène et riche en azote ont été réfutées par de nombreuses personnes (13-15). L’expérience produit en fait un mélange racémique d’acides aminés qui empêcherait la production de protéines utiles.
Après que Watson et Crick ont dévoilé la structure en double hélice de l’ADN en 1953, la recherche sur l’origine de la vie a commencé à se concentrer sur les nucléotides et les processus chimiques complexes susceptibles de créer l’énergie nécessaire à la cellule primitive. Les manuels modernes développent l’expérience de Miller-Urey, largement démentie, et suggèrent en outre l’hypothèse que les nucléotides se forment ensemble dans un environnement primitif, avec des explications telles que l’hypothèse du monde à ARN (16), la thermogenèse (17) et les hypercycles (18). Malheureusement, on n’apprend pas aux étudiants que ces théories requièrent toujours des informations complexes et spécifiques contenues dans des protéines fonctionnelles, qui ne peuvent être expliquées ni auto-générées (19). En outre, on n’apprend pas aux étudiants que les quatre nucléotides ne se forment pas spontanément dans la nature (20). Il n’existe aucun principe d’auto-organisation qui guiderait ou faciliterait l’alignement des nucléotides (21, 22). Tous les nucléotides fabriqués expérimentalement sont des mélanges d’isomères L (orientés vers la gauche) et D (orientés vers la droite). L’ADN n’étant composé que d’isomères D, la probabilité d’un alignement de milliers d’isomères D spécifiques est encore plus faible (23, 24). Même s’il existait un modèle d’auto-organisation, la probabilité qu’un brin de nucléotides, même court, se produise selon un modèle linéaire précisément spécifié qui coderait même pour le plus petit organisme unicellulaire avec environ 250 gènes a été calculée comme étant de 1 sur 10150-1, soit 1070 moins que la probabilité de trouver un électron particulier dans l’univers entier (2).
Outre l’absence de preuves de l’auto-formation des protéines ou des nucléotides, le problème fondamental et insurmontable de l’évolution darwinienne réside dans la complexité remarquable et l’information inhérente contenue dans l’ADN (26). Au cours des cinquante dernières années, les scientifiques modernes ont découvert l’élégance incomparable de l’ADN et les informations qu’il contient pour le codage des protéines. Le schéma fondamental de la cellule se trouve dans l’ADN, qui est composé de quatre nucléotides différents (adénine, cytosine, thymine et guanine). La cellule humaine compte cinq milliards de nucléotides agencés dans un ordre précis, ce qui permet le codage et la formation de 25 000 enzymes et protéines complexes.
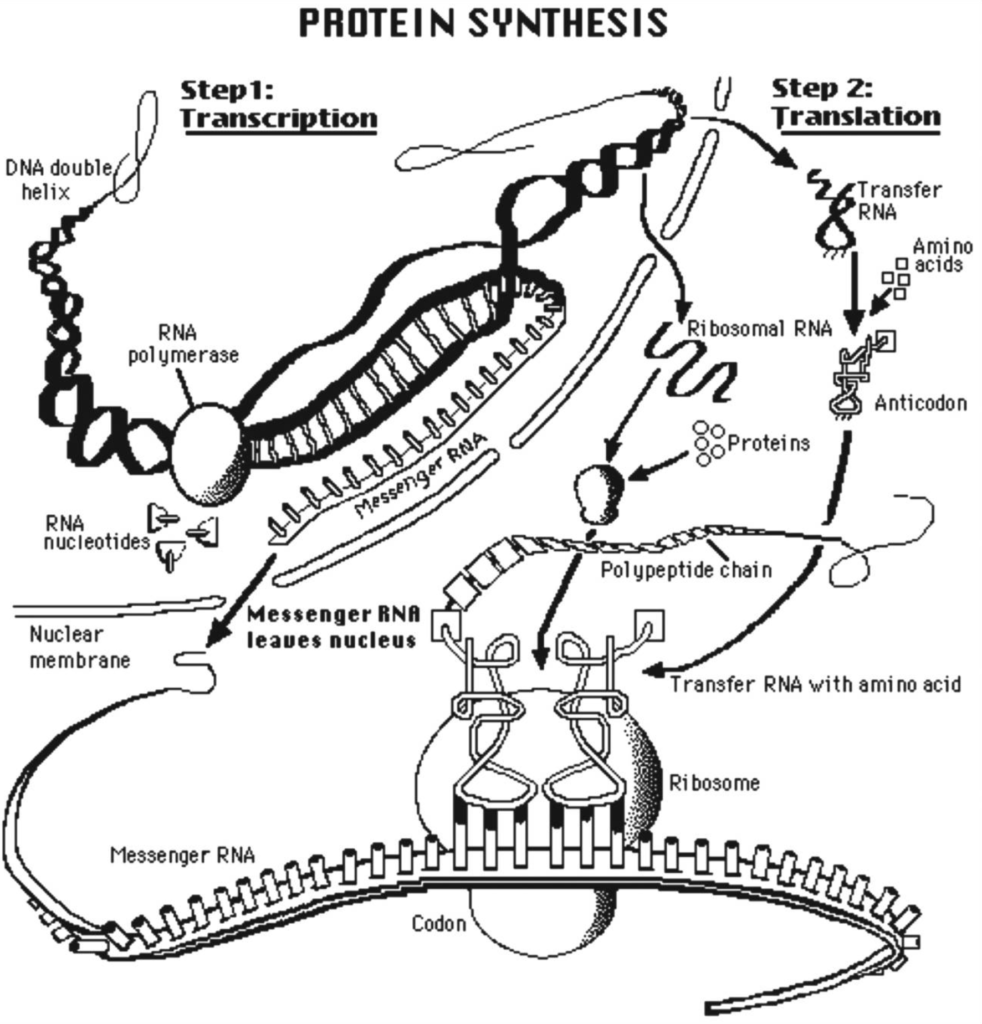
Ce processus de développement des protéines mobilise au moins 200 protéines et cofacteurs uniques (Figure 1). Tout d’abord, la transcription implique la copie de l’ADN en un brin correspondant d’ARN messager composé de nucléotides similaires et de molécules de sucre légèrement différentes. Ensuite, l’ARN messager migre du noyau vers le cytoplasme et est traduit en une protéine dans un ribosome, qui coordonne la livraison d’une fraction spécifique d’acide aminé de l’ARN de transfert. Un codon, composé de trois nucléotides spécifiques, permet l’intégration d’un seul acide aminé spécifique dans une longue série d’acides aminés, qui se plie ensuite en une structure tridimensionnelle spécifique appelée protéine. Les 25 000 enzymes et protéines codées dans chaque cellule du corps humain ont des milliers de fonctions précises, notamment la transduction de signaux depuis la surface, le maintien de concentrations d’électrolytes spécifiques dans des limites très étroites, le stockage et l’utilisation de l’énergie, la fabrication de protéines et la division cellulaire. En résumé, l’ADN de chaque cellule est responsable de la production et du traitement de fonctions soigneusement orchestrées et interdépendantes au sein de la cellule. Par analogie, l’ADN dépasse de loin la complexité des plans et de la production d’un immeuble de 30 étages avec ascenseurs, électricité, plomberie, ordinateurs et climatisation.
Compte tenu des informations codées inexplicables contenues dans l’ADN, de l’inconcevable auto-formation de l’ADN et de l’incapacité d’expliquer les milliards de nucléotides spécifiquement organisés dans chaque cellule, il est raisonnable de conclure que la théorie de l’amélioration graduelle par la sélection naturelle (darwinisme) présente de graves faiblesses pour expliquer l’origine chimique de la vie. En outre, l’évolution darwinienne et la sélection naturelle n’ont pas pu être à l’origine de la vie, car elles nécessitent la réplication pour fonctionner, et il n’y avait pas de réplication avant l’origine de la vie.
La complexité irréductible des systèmes cellulaires
Le médecin étudie et comprend l’énorme complexité du corps humain et de la cellule humaine. Certains aspects de l’évolution darwinienne du corps humain font l’objet d’un consensus – par exemple, les mutations et la sélection naturelle qui influencent la résistance au paludisme, les caractéristiques de la peau et de nombreux autres changements mineurs au sein de l’espèce. Cependant, l’origine et l’explication de la formation d’organes complexes restent floues. À partir d’une seule cellule germinale, l’ADN est suffisant pour coder et contrôler le développement de 50 000 milliards de cellules qui s’organisent en organes complexes sur la base de l’expression de différentes sections de l’ADN, conduisant à des « usines » entièrement différentes qui ont des fonctions aussi diverses que le foie, le cerveau, le cœur et l’œil.
Les partisans des mutations et de la sélection naturelle s’appuient sur une publication scientifique concernant l’évolution de l’œil. Nilsson propose une simulation expliquant comment un point sensible à la lumière avec une couche absorbant la lumière a progressivement évolué vers une coupe, puis un hémisphère rempli d’une substance transparente et enfin, avec les extrémités rapprochées, une ouverture (27). La sélection naturelle devrait théoriquement conduire à une espèce progressivement améliorée, qui s’accouplerait évidemment et créerait des yeux progressivement meilleurs, y compris la formation naturelle d’une lentille, d’une rétine et de la transmission neuronale vers le cerveau.
Cependant, les biochimistes ont montré que même une simple tache sensible à la lumière nécessite un ensemble complexe de systèmes enzymatiques. Lorsque la lumière frappe la rétine, un photon interagit avec une molécule appelée 11-cis-rétinal, qui se réarrange en quelques picosecondes en trans-rétinal. Le changement de forme de la molécule de la rétine entraîne un changement de forme de la protéine rhodopsine. La protéine se transforme alors en métarhodopsine II et se colle à une autre protéine, la transducine. Ce processus nécessite de l’énergie sous forme de GTP, qui se lie à la transducine. Le GTP-transducine-métarhodopsine II se lie ensuite à une protéine appelée phosphodiestérase, située sur la paroi cellulaire. Cela affecte les niveaux de GMPc à l’intérieur de la cellule, conduisant à un signal qui est ensuite transmis au cerveau. La reconnaissance de ce signal dans le cerveau et l’interprétation qui s’ensuit mobilisent de nombreuses autres protéines, enzymes et réactions biochimiques au sein des cellules cérébrales. Chacune de ces enzymes et protéines doit donc exister pour que le système fonctionne correctement. De nombreuses autres faiblesses mathématiques et logistiques de l’exemple de l’évolution de l’œil de Nilsson ont été découvertes (28). En résumé, l’œil est incroyablement complexe. Comme il n’est pas raisonnable de s’attendre à une auto-formation simultanée des enzymes dans des proportions parfaites, la fonction oculaire représente un système qui n’a pas pu apparaître par des mutations graduelles.
Le concept de complexité irréductible suggère que tous les éléments d’un système doivent être présents simultanément au lieu qu’ils aient évolué à travers des améliorations par étapes et de façon séquentielle, comme le théorise l’évolution darwinienne (29). Dans chaque cellule, il existe des dizaines de milliers d’actions complexes, d’étapes enzymatiques et de processus interdépendants supplémentaires qui maintiennent automatiquement l’homéostasie cellulaire, le transport des protéines, l’autoprotection et la réplication. Le fait que ces systèmes irréductiblement complexes soient spécifiquement codés par l’ADN ajoute une autre couche de complexité appelée « complexité spécifiée » (30). Le Dr Geoffrey Simmons a présenté 17 exemples de systèmes irréductiblement complexes dans le corps humain qui n’ont pas pu se former par des mutations séquentielles ou simultanées, puisque tous les composants doivent être présents pour fonctionner correctement (31). Ces systèmes infiniment complexes comprennent la vision, l’équilibre, le système respiratoire, le système circulatoire, le système immunitaire, le système gastro-intestinal, la peau, le système endocrinien et le goût. En outre, pratiquement tous les aspects de la physiologie humaine comportent des éléments de régulation, des boucles de rétroaction et des composantes du développement qui nécessitent des milliers de gènes en interaction conduisant à l’expression de protéines spécifiques. Ces fonctions et la spécification correspondante du code ADN sont d’une complexité trop inconcevable pour être le fruit de mutations ou d’un changement accidentel.
Lorsque John Hunter et Charles Darwin ont constaté des similitudes entre les muscles et la structure corporelle des différentes espèces, ils n’avaient aucune connaissance de l’énorme complexité inhérente à ces organes. Dans les années 1850, Hunter et Darwin auraient pu réaliser la même simulation que Nilsson en alignant simplement une série d’yeux allant du moins complexe au plus complexe et en supposant qu’une sorte d’évolution graduelle sur des milliards d’années en serait responsable. Les scientifiques modernes qui appliquent leur connaissance de la complexité intrinsèque de chaque cellule comprendraient que chaque mutation séquentielle de l’ADN dans le globe oculaire nécessiterait des mutations simultanées dans la structure osseuse, les nerfs, la fonction cérébrale et des centaines de protéines et de voies de signalisation cellulaire pour effectuer ne serait-ce que le plus petit changement dans un seul système d’organes. De tels changements exigeraient bien plus que ce que l’on peut attendre d’une mutation aléatoire et de la sélection naturelle. Étant donné que ces systèmes sont irréductiblement complexes et que des mutations individuelles dans un organe ne seraient pas bénéfiques pour l’organisme, ces mutations aléatoires dans tous les aspects de la vision devraient se produire simultanément. Par conséquent, le corps humain représente un système irréductiblement complexe à l’échelle de la cellule et de l’organe ou du système.
Données sur les espèces de transition
Les espèces de transition entre les primates primitifs et l’homme sont illustrées dans les manuels scolaires depuis plus de 100 ans. Ces dessins constituent l’imagerie visuelle qui soutient l’évolution darwinienne pour les lycéens, les étudiants, les étudiants en médecine et le public. Cependant, l’exactitude de la plupart des préhominoïdes de transition est contestée, beaucoup d’entre eux se révélant être des fraudes ou des espèces animales. Les reconstitutions basées sur des os fragmentaires et dispersés, des os de surface et des caractéristiques morphologiques grossières sont limitées. Des découvertes anormales d’outils en pierre, d’os et de centaines d’autres artefacts ont suggéré que l’Homo sapiens était en fait présent il y a 2 à 7 millions d’années (en même temps que les premières espèces de transition proposées) (32). Il est certain qu’il n’y a pas eu de mutant de transition supplémentaire ni de changement d’espèce depuis le premier Homo sapiens généralement accepté, qui date d’il y a plus de 200 000 ans. L’homologie de l’ADN entre le singe et l’homme est estimée à 96 % si l’on ne tient compte que des séquences actuelles de cartographie des protéines, qui ne représentent que 2 % du génome total. Cependant, la similitude réelle de l’ADN entre le singe et l’homme est d’environ 70 à 75 % si l’on considère le génome complet, y compris l’« ADN poubelle » précédemment présumé, dont il a été démontré qu’il code pour des éléments contribuant à la transcription ou à l’expression (33). La différence de 25 % représente près de 35 millions de changements de nucléotides simples et 5 millions d’insertions ou de suppressions (34). Le passage du singe à l’homme nécessiterait un taux de mutation incroyablement rapide conduisant à la formation d’un nouvel ADN, de milliers de nouvelles protéines et d’innombrables changements cellulaires, neuronaux, digestifs et immunitaires dans l’ADN, qui coderait pour les milliers de nouvelles protéines fonctionnelles. Ce taux de mutation n’a jamais été observé dans aucun organisme viral, bactérien ou autre. L’estimation des mutations aléatoires de l’ADN qui conduiraient à l’intelligence chez l’homme est incalculable. Par conséquent, les différences moléculaires récemment découvertes entre les singes et les humains rendent la perspective d’une simple mutation aléatoire conduisant à une nouvelle espèce d’Homo sapiens largement improbable (35).
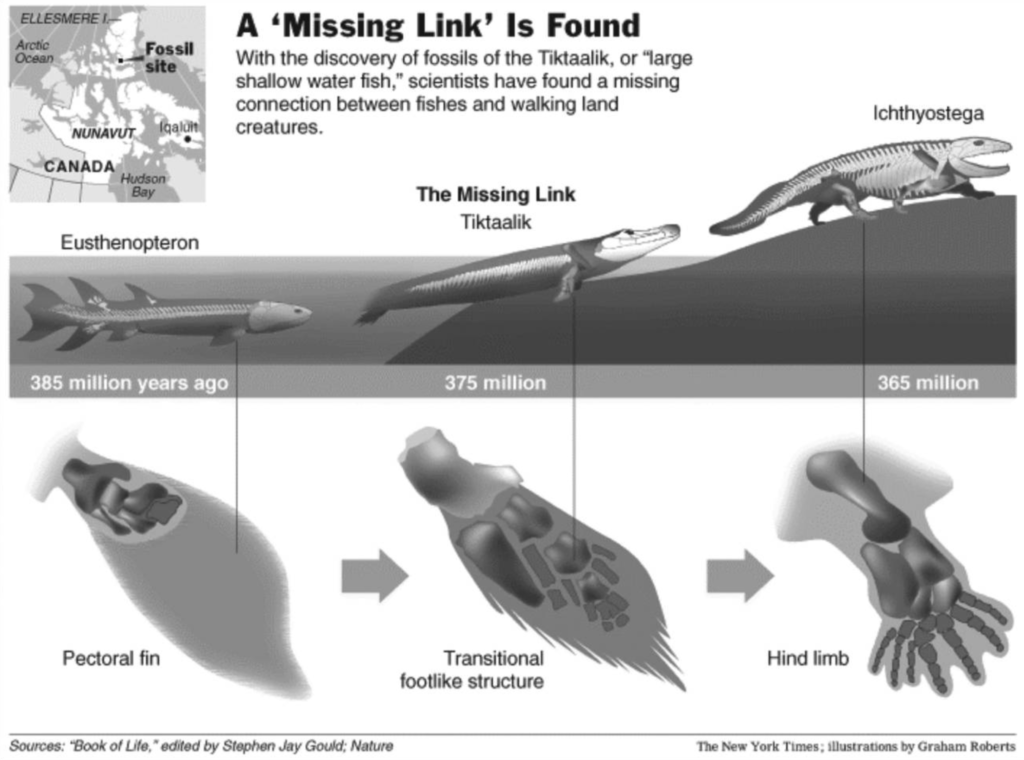
L’espèce de transition de 2004 entre les créatures aquatiques et terrestres (Tiktaalik roseae) s’appuyait sur un fragment d’os retrouvé représentant la structure du poignet qui serait nécessaire pour se déplacer sur la terre ferme (36) (Figure 2). Même si cette espèce a été dénigrée par les milieux scientifiques, il est important de comprendre que toute transition d’un organisme aquatique à un organisme terrestre respirant de l’air nécessiterait également des milliers de mutations simultanées dans la physiologie de base des yeux, du nez, du système alimentaire, des poumons, des muscles et des os. Cela impliquerait des milliers de mutations discrètes dans l’ADN, qui coderaient les changements sous-jacents dans les systèmes cellulaires individuels et les enzymes responsables de ces changements. Un changement d’espèce de transition nécessiterait également un changement simultané dans un autre organisme, permettant la reproduction et la duplication de l’ADN fortement muté.
Le concept d’espèces de transition a été le plus largement étudié en utilisant des plantes invertébrées, des coquillages et des mollusques dans des champs de fossiles soigneusement conservés au Japon, en Malaisie et en Asie. Des milliers de spécimens étaient disponibles à l’époque de Darwin. Au cours des cinquante dernières années, des millions de spécimens ont été classés et étudiés. Il est remarquable que chacun de ces gisements fossiles montre une explosion virtuelle de presque tous les embranchements (35/40) du règne animal en une période relativement courte au cours de l’ère cambrienne, il y a 525 à 530 millions d’années (37) (Figure 3). Depuis lors, il y a eu des extinctions occasionnelles, mais peu de nouveaux embranchements ont été identifiés de manière convaincante (38). L’article fondateur des paléoanthropologues J. Valentine et D. H. Erwin note que l’absence d’espèces de transition pour l’un ou l’autre des embranchements cambriens limite l’explication néodarwinienne de l’évolution (39).

Enfin, l’évolution ou l’adaptation bactérienne offre une excellente occasion d’observer les mutations dans une espèce à division cellulaire rapide. La biologie évolutive peut être modélisée sur une période relativement courte (30 ans), tout en observant les mutations de l’ADN sur 1020 générations (40). Ceci est analogue à l’observation des mutations chez l’homme ou tout autre mammifère sur 200 millions d’années. Un examen récent de nombreux documents relatifs à l’évolution virale et bactérienne au cours des 40 dernières années a révélé que la grande majorité des mutations entraînaient une perte ou une légère modification de la fonction qui conférait une résistance ou un avantage en termes de survie (41). Ces mutations spécifiques comprenaient des délétions simples, des substitutions, des mutations par décalage de cadre, des inversions et des insertions. Aucune mutation de gain de fonction n’a été observée dans les études sur l’évolution bactérienne à long terme. Seules deux mutations avec gain de fonction ont été observées dans les études sur l’évolution virale à long terme. L’absence de mutations conduisant à une nouvelle protéine unique suggère la difficulté d’utiliser les mutations pour expliquer le développement de nombreuses nouvelles protéines codées spécifiquement par des milliers de nucléotides dans un ordre précis, interagissant avec de nombreuses autres enzymes de manière simultanée pour accomplir une action cellulaire unique telle que la fabrication cellulaire d’un seul nucléotide.
La complexité de la création de deux mutations séquentielles ou simultanées susceptibles d’améliorer la survie a été étudiée chez le parasite du paludisme exposé à la chloroquine. L’incidence réelle de deux mutations de paires de bases conduisant à deux acides aminés modifiés entraînant une résistance s’est avérée être de 1 cas sur 1020 (42). Pour mieux comprendre cette incidence, la probabilité que l’Homo sapiens réalise une seule mutation du type de celle requise pour que le paludisme devienne résistant à la chloroquine (un simple changement de deux acides aminés) serait de 100 millions fois 10 millions d’années (plusieurs fois l’âge de l’univers). Cet exemple a été utilisé pour expliquer plus en détail la difficulté de gérer plus d’une mutation pour obtenir un bénéfice.
En toute honnêteté, il existe des preuves convaincantes, largement reconnues, que des mutations aléatoires et des adaptations naturelles (évolution darwinienne) se produisent au sein des espèces, entraînant des changements mineurs dans des domaines tels que la taille du bec, la pigmentation de la peau ou la résistance aux antibiotiques. Certains de ces changements impliquent un simple avantage biologique pour la survie d’une population, sans mutations de l’ADN. D’autres peuvent être influencés par une simple suppression ou insertion dans le brin d’ADN. Toutefois, les données modernes sur l’évolution ne sont pas convaincantes pour justifier le passage d’un poisson à un amphibien, qui nécessiterait une quantité massive de nouvelles enzymes, de systèmes protéiques, de systèmes organiques, de chromosomes et la formation de nouveaux brins d’ADN codant spécifiquement. Même avec des milliers de milliards de générations, l’expérience montre que les nouvelles caractéristiques biologiques complexes qui nécessitent de multiples mutations pour conférer un avantage n’apparaissent pas par sélection naturelle et mutations aléatoires. Il est difficile de faire évoluer de nouveaux gènes. Les bactéries ne se transforment pas en d’autres espèces. Se fier aux apparences morphologiques grossières, comme dans le cas des fossiles, des dessins et des reconstitutions osseuses, est très insuffisant par rapport à la compréhension de la complexité de l’ADN et du codage qui auraient été nécessaires pour passer d’un poisson à un amphibien ou d’un primate primitif à un être humain.
Changement de paradigme
Dans son ouvrage de référence, The Structure of Scientific Revolutions (La structure des révolutions scientifiques), Thomas S. Kuhn, professeur au Massachusetts Institute of Technology, a donné au terme paradigme sa signification contemporaine en l’utilisant pour décrire des réalisations scientifiques universellement reconnues qui, pendant un certain temps, fournissent des problèmes et des solutions modèles à une communauté de praticiens (43). Un changement de paradigme peut être annoncé par l’apparition de « contre-indications ou d’anomalies », qui représentent des exceptions à la logique ou des exagérations des preuves. Selon Kuhn, ces changements entraînent des conflits, des débats et une grande résistance, voire des accusations selon lesquelles les nouveaux théoriciens ont ignoré la « science ». Parmi les exemples de ces changements progressifs de paradigme, qui ont commencé comme des failles dans l’armure établie de la science, on peut citer Copernic contre Ptolémée en astronomie, Lavoisier contre Priestly dans le domaine des gaz, et Einstein contre Newton dans le domaine de la dynamique relativiste.
Les principaux conflits ou anomalies de l’évolution néodarwinienne résident dans l’incapacité des mutations et de la sélection naturelle de rendre compte de la formation de l’ADN, de l’information contenue dans l’ADN ou de la complexité de la cellule humaine. En toute honnêteté, de nombreux médecins, étudiants en médecine et étudiants de l’enseignement supérieur n’ont pas été sensibilisés aux faiblesses de l’évolution darwinienne. On ne leur a pas montré l’échec des expériences de Miller-Urey pour expliquer la formation de l’ADN, de l’ARN ou des protéines, la rareté des données fossiles ou les réfutations des espèces de transition basées sur une compréhension biochimique croissante des systèmes complexes et les limites des mutations de l’ADN pour expliquer la formation d’un nouvel ADN, de nouveaux chromosomes et, par conséquent, de nouvelles espèces.
En revanche, comment est-il possible que la majorité des membres de l’Académie nationale des sciences (qui devraient connaître les faiblesses susmentionnées) croient fermement que les mutations aléatoires et la sélection naturelle peuvent expliquer l’origine de l’ADN et la génération ultérieure d’une vaste panoplie de systèmes protéiques au sein de cellules complexes ? Il est possible que le biologiste, le paléontologue et l’anthropologue n’étudient chacun qu’une petite partie du tableau et qu’ils n’aient pas l’éducation et la formation nécessaires pour voir l’ensemble du tableau. Il est plus probable que leurs recherches antérieures s’appuient sur le paradigme établi de l’évolution darwinienne pour structurer leur travail. Lorsque les limites des paradigmes existants deviennent évidentes, l’adoption d’un nouveau paradigme nécessite généralement au moins une génération entière, car les praticiens et les scientifiques en place s’accrochent souvent à l’ancien paradigme.
Lorsque le Conseil de l’éducation de l’État du Texas a voté pour reconnaître les faiblesses de l’évolution darwinienne dans l’explication de l’origine des espèces, cela a été le résultat de trois jours entiers de débats intenses et de disputes scientifiques. En 2011, lorsque de nouveaux manuels ont été présentés au Conseil de l’éducation de l’État, 9 sur 10 n’ont pas fourni les programmes complémentaires obligatoires, qui devaient inclure les aspects positifs et négatifs de l’évolution (44). En outre, plusieurs de ces manuels continuaient à promouvoir à tort l’expérience de Miller-Urey sur l’origine de la vie, qui avait été démentie, les affirmations longtemps discréditées sur l’appendice et les amygdales non fonctionnels, et les dessins d’embryons frauduleux d’Ernst Haeckel. En fait, les étudiants en biologie, les futurs étudiants en médecine et les futurs scientifiques n’apprennent pas toute l’histoire. Au contraire, les preuves suggèrent qu’ils continuent à recevoir des informations incorrectes et incomplètes qui exagèrent l’effet des mutations aléatoires et de la sélection naturelle pour expliquer l’ADN, la cellule ou la transition d’une espèce à l’autre.
Les lignes directrices du Conseil de l’éducation de l’État du Texas ne proposent pas d’enseigner d’autres alternatives à l’évolution darwinienne. Au contraire, les étudiants de demain et les enseignants d’aujourd’hui devraient reconnaître comme il se doit qu’il existe des faiblesses qui ont été mises en évidence par des scientifiques raisonnables. Dans cette dissection du darwinisme, nous avons abordé les faiblesses des preuves fossiles de l’évolution humaine, l’incapacité des données fossiles de démontrer l’existence d’espèces de transition substantielles et la prise de conscience de la formation soudaine de la plupart des espèces dans un court laps de temps, sans variations ultérieures significatives. Plus important encore, cet article souligne l’extrême impossibilité de la formation naturelle ou de l’auto-formation de milliards de nucléotides dans une séquence spécifique, permettant le codage de l’ARN et des protéines dans une cellule complexe avec des milliers de fonctions interdépendantes et irréductiblement complexes. L’article éclaire également le lecteur sur les conflits et la difficulté d’utiliser la sélection naturelle et les mutations pour expliquer les changements simultanés ou séquentiels dans l’ADN cellulaire, impliquant des brins d’ADN entièrement nouveaux et des milliers de nouvelles protéines, qui sont nécessaires à la formation de nouvelles espèces.
John Hunter et Charles Darwin se sont limités à l’observation brute de l’apparence physique. La cellule humaine apparaissait comme une boule de gelée sous un microscope primitif. Les deux scientifiques ont observé des mutations et des adaptations, qui existent clairement aujourd’hui. Pendant près de 150 ans après leur proposition, des milliers d’articles et de départements de biologie à travers le monde ont fait des observations fondées sur le paradigme des mutations aléatoires et de la sélection naturelle pour expliquer les changements au sein des espèces. Ces changements sont des vérités incontestées. Cependant, en ce qui concerne l’origine des espèces et de la vie (ADN), Darwin lui-même a déclaré : « Si l’on pouvait démontrer que des systèmes complexes ne peuvent pas apparaître par de petites étapes séquentielles, alors ma théorie s’effondrerait complètement. » Des systèmes irréductiblement complexes impliquant des milliers d’enzymes codées spécifiquement et interdépendantes existent dans chaque organe du corps humain. Au minimum, l’inconcevable auto-formation de l’ADN et l’incapacité d’expliquer l’incroyable information contenue dans l’ADN représentent des défauts fatals dans le concept de mutations et de sélection naturelle pour rendre compte de l’origine de la vie et de l’origine de l’ADN. Alors que de nouvelles théories émergent pour expliquer l’origine de la vie, les inévitables accusations émotionnelles d’hérésie et d’ignorance ne sont pas surprenantes dans une période de révolution scientifique. Il est donc temps d’aiguiser l’esprit des étudiants, des biologistes et des médecins à la possibilité d’un nouveau paradigme.
Références
1. Moore M. The Knife Man. New York : Broadway Books ; 2005 ; pp. 42-43. [Google Scholar.]
2. McLoughlin J. M., McCarty T. M., Cunningham C., Clark V., Senzer N., Nemunaitis J., Kuhn J. A. TNFerade, an adenovector carrying the transgene for human tumor necrosis factor alpha, for patients with advanced solid tumors: surgical experience and long-term follow-up. Ann. Surg. Oncol. 2005 ;12(10):825-830. [PubMed] [Google Scholar]
3. Nemunaitis G., Jay C. M., Maples P. B., Gahl W. A., Huizing M., Yardeni T., Tong A. W., Phadke A. P., Pappen B. O., Bedell C., Allen H., Hernandez C., Templeton N. S., Kuhn J., Senzer N., Nemunaitis J. Hereditary inclusion body myopathy: single patient response to intravenous dosing of GNE gene lipoplex. Hum. Gene. Ther. 2011 ; 12(5):403-412. [PMC free article] [PubMed] [Google Scholar]
4. Olivares J., Kumar P., Yu Y., Maples P. B., Senzer N., Bedell C., Barve M., Tong A., Pappen B. O., Kuhn J., Magee M., Wallraven G., Nemunaitis J. Phase I trial of TGFb2 antisense GM-CSF gene-modified autologous tumor cell (TAG) vaccine. Clin. Cancer Res. 2011 ; 17(1):183–192. [PubMed] [Google Scholar]
5. Holistic Communications Decisions. Majority of physicians give the nod to evolution over intelligent design [press release]. Disponible à l’adresse : http://www.hcdi.net/news/PressRelease.cfm?ID=93 ; consulté le 24 août 2011.
6. Martz L., McDaniel A. Keeping God out of class. Newsweek, 29 juin 1987:22-23.
7. Faculté des Sciences, Université de New South Wales. Intelligent design is not science—scientists and teachers speak out, 20 octobre 2005. Disponible à cette adresse http://web.archive.org/web/20070811105349/http://www.science.unsw.edu.au/news/2005/intelligent.html ; consulté le 24 août 2011.
8. Kitzmiller v. Dover Area School District. Dans Wikipedia. Disponible à l’adresse : http://en.wikipedia.org/wiki/Kitzmiller_v._Dover_Area_School_District ; consulté le 24 août 2011.
9. National Center for Science Education. Science setback for Texas schools [press release]. Disponible à cette adresse : http://ncse.com/news/2009/03/science-setback-texas-schools-004708 ; consulté le 23 août 2011.
10. Miller S. L. A production of amino acids under possible primitive earth conditions. Science. 1953 ; 117:528-529. [PubMed] [Google Scholar]
11. Miller S. L, Urey C., Oró J. Origin of organic compounds on the primitive earth and in meteorites. J. Mol. Evol. 1976 ; 9(1):59-72. [PubMed] [Google Scholar]
12. Mills G., Lancaster M., Bradley W. Origin of life and evolution in biology textbooks: a critique. Dans Campbell J., Meyer S., éditeurs. Darwinism, Design, and Public Education. East Lansing, MI : Michigan State University Press ; 2003 ; pp. 207–219. [Google Scholar]
13. Thaxton C. B., Bradley W. L., Olsen R. L. The Mystery of Life’s Origin: Reassessing Current Theories. Vol. 42. New York : Philosophical Library ; 1984 ; pp. 69-80. [Google Scholar]
14. Levine J. S. The photochemistry of the paleoatmosphere. J. Mol. Evol. 1982 ; 18(3):161-172. [PubMed] [Google Scholar]
15. Shapiro R. Origins: A Skeptic’s Guide to the Creation of Life on Earth. New York : Summit Books ; 1986. [Google Scholar]
16. Ma W., Yu C., Zhang W., Hu J. Nucleotide synthetase ribozymes may have emerged first in the RNA world. RNA. 2007 ; 13(11):2012-2019. [PMC free article] [PubMed] [Google Scholar]
17. Muller A. W. Thermosynthesis by biomembranes: energy gain from cyclic temperature changes. J. Theor. Biol. 1985 ; 115(3):429-453. [PubMed] [Google Scholar]
18. Eigen M., Schuster P. The hypercycle. A principle of natural self-organization. Part A: Emergence of the hypercycle. Naturwissenschaften. 1977 ; 64(11):541-565. [PubMed] [Google Scholar]
19. Joyce G. F. RNA evolution and the origins of life. Nature. 1989 ; 38:217-224. [PubMed] [Google Scholar]
20. Shapiro R. Prebiotic cytosine synthesis: a critical analysis and implications for the origin of life. Proc. Natl Acad. Sci. USA. 1999 ; 96(8):4396-4401. [PMC free article] [PubMed] [Google Scholar]
21. Thaxton C., Bradley W., Olsen R. The Mystery of Life’s Origin: Reassessing Current Theories. Dallas : Lewis and Stanley ; 1992 ; pp. 5-8. [Google Scholar]
22. Kenyon D., Mills G. The RNA world: a critique. Origins and Design. 1996 ; 17:9-16. [Google Scholar]
23. Yockey H. P. A calculation of the probability of spontaneous biogenesis by information theory. J. Theor. Biol. 1977 ; 67(3):377-398. [PubMed] [Google Scholar]
24. Mora P. T. The folly of probability. Dans : Fox S. W., éditeur. The Origins of Prebiological Systems and of Their Molecular Matrices. New York : Academic Press ; 1965 ; pp. 39-64. [Google Scholar]
25. Dembski W. Design Inference. Eliminating chance through small probabilities. Cambridge, Royaume-Uni : Cambridge University Press ; 1998 ; pp. 67-91, 175-223. [Google Scholar]
26. Meyer S. C. Signature in the Cell. New York : Harper Collins ; 2009. The double helix ; pp. 58-84. [Google Scholar]
27. Nilsson D. E., Pelger S. A pessimistic estimate of the time required for an eye to evolve. Proc. Biol. Sci. 1994 ; 256(1345):53-58. [PubMed] [Google Scholar]
28. Berlinski D. A scientific scandal [Commentary]. Seattle, WA : Discovery Institute Center for Science and Culture. Disponible à cette adresse : http://www.discovery.org/a/1408 ; consulté le 12 septembre 2011.
29. Behe M. J. Darwin’s Black Box: The Biochemical Challenge to Evolution. New York : Free Press ; 1996. [Google Scholar]
30. Meyer SC. Signature in the Cell: DNA and the Evidence for Intelligent Design. New York : HarperCollins ; 2009 ; p. 365. [Google Scholar]
31. Simmons G. What Darwin Didn’t Know: A Doctor Dissects the Theory of Evolution. Eugene, OR : Harvest Publishers ; 2004. [Google Scholar]
32. Cremo M. A., Thompson R. L. Forbidden Archeology. San Diego, CA : Bhaktivedanta Institute ; 1993. [Google Scholar]
33. Wells J. The Myth of Junk DNA. Seattle, WA : Discovery Institute Press ; 2011. [Google Scholar]
34. Chimpanzee Sequencing and Analysis Consortium Initial sequence of the chimpanzee genome and comparison with the human genome. Nature. 2005 ; 437(7055):69-87. [PubMed] [Google Scholar]
35. Durrett R., Schmidt D. Waiting for two mutations: with applications to regulatory sequence evolution and the limits of Darwinian evolution. Genetics. 2008 ; 180(3):1501-1509. [PMC free article] [PubMed] [Google Scholar]
36. Luskin C. Tiktaalik roseae: where’s the wrist? (Mise à jour). Evolution News and Views, 14 juillet 2008. Disponible à l’adresse suivante :
http://www.evolutionnews.org/2008/07/tiktaalik_roseae_wheres_the_wr008921.html ; consulté le 12 septembre 2011.
37. Meyer S. C., Ross R., Nelson P., Shien P. The Cambrian explosion: biology’s big bang. Dans : Campbell J., Meyer S. C., éditeurs. Darwinism, Designs, and Public Education. East Lansing, MI : Michigan State University Press ; 2003 ; pp. 323-401. [Google Scholar]
38. Stanley S. Macroevolution Pattern and Process. San Francisco, CA : Freeman Press ; 1979 ; p. 39. [Google Scholar]
39. Valentine J. W., Erwin D. H. Interpreting great developmental experiments: the fossil record. Dans : Raff R. A., Raff E. C., éditeurs. Development as an Evolutionary Process. New York : Alan R. Liss ; 1987 ; pp. 74-96. [Google Scholar]
40. Linton A. Scant search for the maker. The Times Higher Education Supplement, 20 avril 2001, section de livre, p. 29.
41. Behe M. J. Experimental evolution, loss-of-function mutations, and “the first rule of adaptive evolution”. Q. Rev. Biol. 2010 ; 85(4):419-445. [PubMed] [Google Scholar]
42. Behe M. J. The Edge of Evolution. New York : Free Press ; 2007 ; pp. 60-65. [Google Scholar]
43. Kuhn T. S. The Structure of Scientific Revolutions. Chicago, IL : University of Chicago Press ; 1970. [Google Scholar]
44. Center for Science and Culture du Discovery Institute. An Evaluation of Supplementary Biology and Evolution Curricular Materials Submitted for Adoption by the Texas State Board of Education. 7 septembre 2011. Extrait de http://www.discovery.org/f/7711 ; consulté le 12 septembre 2011.
Référence : Proceedings of Baylor University Medical Center. Janvier 2012 ; 25(1):4147. Doi : 10.1080/08998280.2012.11928781.
Source : https://www.ncbi.nlm.nih.gov/pmc/articles/PMC3246854/
A propos de l’auteur

Joseph Kuhn est né à Ames, dans l’Iowa, le 3 octobre 1958, et a grandi principalement à Lincoln, dans le Nebraska, à Lawton, dans l’Oklahoma, et à Kansas City, dans le Missouri, aux Etats-Unis. Il est le troisième d’une fratrie de six enfants. Après avoir fréquenté les écoles publiques et passé une année à l’Université du Missouri à Kansas City, il est entré à l’Université A&M du Texas, où il a obtenu une licence en biochimie avec mention Très bien. Il a obtenu son diplôme avec mention à la Branche médicale de l’Université du Texas (UTMB) à Galveston en 1984, après avoir reçu le prix Alpha Omega Alpha au cours de sa dernière année d’études. Il a effectué son internat de cinq ans en chirurgie générale au Centre médical de l’Université de Baylor (BUMC) ; au cours de sa dernière année, il a été chef des résidents. Après avoir terminé ce programme en 1989, il a effectué un stage en chirurgie oncologique au Centre médical national City of Hope à Duarte, en Californie, qu’il a achevé en 1992. Il est ensuite retourné au BUMC, où il a ouvert un cabinet privé de chirurgie générale et d’oncologie chirurgicale.
Depuis son retour au BUMC, il a joué un rôle majeur dans l’enseignement des résidents en chirurgie et a reçu le prix de l’enseignement exceptionnel décerné par le BUMC à au moins cinq reprises. De plus, alors qu’il était chef des résidents dans le programme de résidence chirurgicale du BUMC, il a reçu le prix de l’enseignant exceptionnel de l’hôpital John Peter Smith (JPS), où il a passé 25 % de sa formation de résident en chirurgie. Le Dr Kuhn a été actif au sein de plusieurs sociétés chirurgicales et a donné 125 présentations lors de réunions de diverses sociétés. Il a été extrêmement actif dans le domaine de la recherche et a été l’un des principaux responsables de l’implication des résidents en chirurgie du BUMC dans les activités de recherche. Il a publié plus de 70 articles dans des revues médicales évaluées par des pairs. Ses efforts de recherche ont été continus depuis sa dernière année d’internat en chirurgie jusqu’à aujourd’hui. Le Dr Kuhn est un acteur majeur du BUMC depuis près de vingt ans. Outre ses compétences chirurgicales, c’est un être humain merveilleux qui fait honneur au BUMC. Lui et son épouse, Mollie, sont les fiers parents de trois enfants.
Le Dr Joseph Allen Joseph est décédé le dimanche 20 juillet 2014 à l’âge de 55 ans, pour être avec son Père céleste et son Seigneur Jésus. On se souviendra toujours de lui comme d’un mari, d’un père, d’un fils, d’un frère, d’un chirurgien et d’un ami aimant. Le Dr Joseph Allen Kuhn est né à Ames, dans l’Iowa, le 3 octobre 1958, au sein d’une famille catholique aimante. Il est fier des nombreuses décisions qu’il a prises dans sa vie, toujours en s’en remettant à Dieu. Par la grâce de Dieu, il a réussi à entrer à l’Université Texas A&M, où il a rencontré son âme sœur et son épouse depuis 36 ans, Mollie. Ensemble, ils ont eu la chance d’avoir trois magnifiques enfants, Kristin en 1989, Courtney en 1992 et Kevin en 1994.
Sources :