Problème n° 6 pour l’évolution : la biologie moléculaire n’a pas réussi à produire un grand « arbre de la vie ».
Par Casey Luskin
23 juillet 2020
Bienvenue dans le Top 10 des problèmes scientifiques liés à l’évolution biologique et chimique.
Note de l’éditeur : Il s’agit de la sixième partie d’une série de dix articles basés sur le chapitre de Casey Luskin, « Les dix principaux problèmes scientifiques liés à l’évolution biologique et chimique« , du livre More than Myth, édité par Paul Brown et Robert Stackpole (Chartwell Press, 2014.) Le chapitre complet peut être consulté en ligne ici. Les autres chapitres individuels peuvent être consultés ici : Problème 1, Problème 2, Problème 3, Problème 4, Problème 5, Problème 6, Problème 7, Problème 8, Problème 9, Problème 10, Problème supplémentaire.
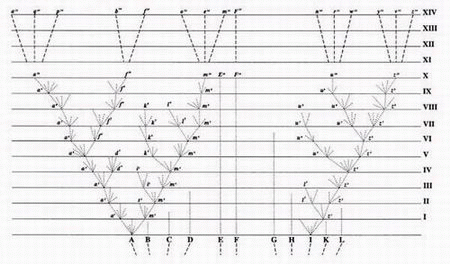
L’arbre de la vie tel qu’il apparaît dans « On the Origin of Species by Natural Sélection » de Charles Darwin, 1859.
Lorsque les fossiles ne réussirent pas à prouver que les animaux avaient évolué à partir d’un ancêtre commun, les scientifiques évolutionnistes se tournèrent vers un autre type de preuves – les données issues de séquences d’ADN – pour démontrer un arbre de la vie. Dans les années 1960, à l’époque où le code génétique était compris pour la première fois, les biochimistes Émile Zuckerkandl et Linus Pauling émirent l’hypothèse selon laquelle, si les séquences d’ADN pouvaient être utilisées pour produire des arbres de l’évolution – des arbres qui correspondraient à ceux construits sur la base des caractéristiques morphologiques ou anatomiques – cela constituerait « la meilleure preuve par excellence de la réalité de la macroévolution99. » C’est ainsi que débuta un projet laborieux, qui s’étendrait sur plusieurs décennies, de séquençage des gènes de nombreux organismes et de construction des arbres de l’évolution (« phylogénétiques ») fondés sur des caractéristiques « moléculaires ». Le but ultime était de construire un grand « arbre de la vie » qui montrerait comment tous les organismes vivants sont reliés entre eux par une ascendance commune universelle.
L’hypothèse principale
La logique de base derrière la construction d’arbres moléculaires est relativement simple. Tout d’abord, les chercheurs choisissent un gène, ou une série de gènes, que l’on trouve dans plusieurs organismes. Ensuite, ces gènes sont analysés dans le but de déterminer leurs séquences nucléotidiques, afin de pouvoir ensuite comparer les séquences de gènes de divers organismes. Enfin, un arbre évolutif est construit en partant du principe que plus la séquence de nucléotides est similaire, plus les espèces sont étroitement apparentées. C’est ce qu’explique un article paru dans la revue Biological Theory :
« La systématique moléculaire est (largement) fondée sur l’hypothèse, clairement énoncée pour la première fois par Zuckerkandl et Pauling (1962), selon laquelle le degré de similitude globale reflète le degré de parenté100. »
Cette hypothèse est essentiellement l’énonciation d’une caractéristique majeure de la théorie – l’idée d’une ascendance commune universelle. Néanmoins, il est important de réaliser qu’il s’agit d’une simple hypothèse que de prétendre que les similitudes génétiques entre différentes espèces résultent nécessairement d’une ascendance commune.
Ces hypothèses découlent naturellement d’un cadre de travail modelé strictement par le paradigme darwinien. Comme l’explique l’article de Biological Theory mentionné ci-dessus, la principale hypothèse qui sous-tend les arbres moléculaires « découle de l’interprétation des similitudes (ou dissimilitudes) moléculaires entre les taxa dans le contexte d’un modèle darwinien de changements continus et progressifs101. » L’on suppose donc que la théorie est vraie pour construire un arbre. Mais également, si l’évolution darwinienne est vraie, la construction d’arbres utilisant des séquences différentes devrait révéler un schéma raisonnablement cohérent entre différents gènes ou séquences.
Cela rend donc d’autant plus significatif le fait que les efforts déployés pour construire un grand « arbre de la vie » en utilisant l’ADN ou d’autres données de séquences biologiques n’ont pas été conformes aux attentes. Le problème fondamental est qu’un gène donne une certaine version de l’arbre de la vie, tandis qu’un autre gène donne une version très différente et contradictoire de l’arbre. Par exemple, comme nous le verrons plus loin, l’arbre conventionnel des mammifères place l’homme dans une position plus proche des rongeurs que des éléphants. Mais des études sur un certain type d’ADN appelé gènes de microARN ont suggéré le contraire, à savoir que les humains étaient plus proches des éléphants que des rongeurs. De tels conflits entre les arbres fondés sur les gènes sont extrêmement fréquents.
Les données génétiques ne brossent donc pas un tableau cohérent de l’ascendance commune, ce qui montre que les hypothèses qui sous-tendent la construction des arbres sont souvent incorrectes. Cela conduit à se demander, à juste titre, si l’ascendance commune universelle est correcte.
Conflits à la base de l’arbre de la vie
Les problèmes apparurent pour la première fois lorsque les biologistes moléculaires séquencèrent des gènes des trois mondes fondamentaux du vivant – les eubactéries, les archébactéries et les eucaryotes -, mais que ces gènes ne permirent pas d’arranger ces groupes fondamentaux du vivant selon un schéma arborescent. En 2009, la revue New Scientist publia un article de couverture intitulé « Pourquoi Darwin avait tort à propos de l’arbre de la vie » qui expliquait ces dilemmes :
« Les problèmes commencèrent au début des années 1990, lorsqu’il devint possible de séquencer de véritables gènes bactériens et archéaux plutôt que simplement de l’ARN. Tout le monde s’attendait à ce que ces séquences d’ADN confirmassent l’arbre de l’ARN, et quelquefois c’était bien le cas, mais, ce qui est crucial, quelquefois ce n’était pas vrai. L’ARN, par exemple, pourrait suggérer que l’espèce A est plus étroitement liée à l’espèce B que l’espèce C, mais un arbre établi à partir d’ADN suggérerait l’inverse102. »
Ce type de données conduisit le biochimiste W. Ford Doolittle à expliquer que « les phylogénistes moléculaires n’auront pas réussi à trouver le « véritable arbre », non pas parce que leurs méthodes sont inadéquates ni parce qu’ils avaient choisi les mauvais gènes, mais parce que l’histoire de la vie ne peut pas être correctement représentée sous la forme d’un arbre103. » Le New Scientist l’exprima ainsi :
« Pendant longtemps, le Saint Graal a consisté à construire un arbre de la vie … Mais aujourd’hui, le projet est en lambeaux, mis en pièces par une avalanche de preuves négatives104. »
De nombreux évolutionnistes répondent quelquefois que ces problèmes ne se posent que lors de l’étude de micro-organismes comme les bactéries – des organismes qui peuvent échanger des gènes par un processus appelé « transfert horizontal de gènes », brouillant ainsi le signal des relations évolutives. Mais cette objection n’est pas tout à fait vraie, puisque l’arbre de la vie est remis en question même chez les organismes supérieurs où ce type d’échanges de gènes n’est pas fréquent. Carl Woese, un pionnier de la systématique moléculaire évolutive, l’explique ainsi :
« Les incongruités phylogénétiques sont visibles partout dans l’arbre universel, de sa racine aux principales ramifications au sein des différents taxa et entre eux, jusqu’à la composition des regroupements élémentaires eux-mêmes105. »
De même, l’article du New Scientist note que
« la recherche suggère que l’évolution des animaux et des plantes n’est pas exactement suivant le modèle d’un arbre non plus106. »
L’article explique ce qu’il s’est passé lorsque le microbiologiste Michael Syvanen a essayé de créer un arbre montrant les relations évolutives en utilisant 2000 gènes d’un groupe de divers animaux :
« Il échoua. Le problème était que différents gènes racontaient des histoires évolutives contradictoires… les gènes envoyaient des signaux contradictoires … Environ 50 % de ses gènes ont une histoire évolutive et 50 % une autre107. »
Les données étaient si difficiles à transformer en un arbre que Syvanen le déplora dans les termes suivants :
« Nous venons d’anéantir l’arbre de la vie108. »
De nombreux autres articles de la littérature technique reconnaissent des problèmes similaires.
Conflits entre les branches supérieures
Un article paru en 2009 dans Trends in Ecology and Evolution note qu' »un défi majeur pour l’intégration d’une telle quantité de données dans une démarche aboutissant à l’inférence des arbres des espèces est que des histoires généalogiques conflictuelles existent souvent dans différents gènes à travers le génome109. » De même, un article paru dans Genome Research a étudié les séquences d’ADN dans divers groupes d’animaux et a trouvé que « différentes protéines génèrent différents arbres phylogénétiques110. » Un article paru en juin 2012 dans Nature a rapporté que de courts brins d’ARN appelés microARN « mettent en pièces les idées traditionnelles sur l’arbre généalogique des animaux ». Kevin Peterson, biologiste de Dartmouth qui étudie les microARN, a exprimé ses regrets par les mots suivants :
« J’ai examiné des milliers de gènes de microARN, et je ne trouve pas un seul exemple qui pourrait soutenir l’arbre traditionnel. »
Selon cet article, les microARN ont donné « un diagramme radicalement différent pour les mammifères : un diagramme qui aligne les humains plus étroitement sur les éléphants que sur les rongeurs ». Peterson l’a dit sans détours :
« Les microARN sont totalement dépourvus d’ambiguïté… ils donnent un arbre totalement différent de ce que tout le monde veut111. »
Conflits entre molécules et morphologie
Tous les arbres phylogénétiques ne sont pas construits en comparant des molécules comme l’ADN de différentes espèces. De nombreux arbres reposent sur la comparaison de la forme, de la structure et du plan d’organisation de différents organismes – ce qui est également appelé « morphologie ». Mais les conflits entre les arbres basés sur les molécules et les arbres basés sur la morphologie sont également fréquents. Un article de 2012 étudiant les relations entre les chauves-souris l’a clairement montré, en déclarant :
« Les incongruités entre les phylogénies dérivées d’analyses morphologiques d’un côté et moléculaires de l’autre, et entre les arbres basés sur différents sous-ensembles de séquences moléculaires se sont multipliées au point de devenir très fréquentes, car les ensembles de données se sont rapidement développés à la fois en termes d’individus et d’espèces112. »
Cette étude n’est pas la seule à avoir rencontré des conflits entre les arbres construits sur la base de l’ADN et les arbres construits sur la base des caractéristiques anatomiques ou morphologiques. Les manuels scolaires affirment souvent que l’ascendance commune est étayée par l’exemple d’un arbre d’animaux construit sur la base de l’enzyme cytochrome c qui correspond à l’arbre de l’évolution traditionnel s’appuyant sur la morphologie113. Comme l’a observé un article de Trends in Ecology and Evolution :
« Le gène du cytochrome b mitochondrial donnait lieu à… une phylogénie absurde des mammifères, quelle que soit la méthode de construction de l’arbre. Les chats et les baleines faisaient partie des primates, se regroupant avec les simiens (singes du Nouveau Monde et singes de l’Ancien Monde) et les streptococcines (lémuriens, galagos et loris) à l’exclusion des tarsiers. Le cytochrome b est probablement le gène le plus couramment séquencé chez les vertébrés, ce qui rend ce résultat surprenant encore plus déconcertant114. »
De façon frappante, un autre article de Trends in Ecology and Evolution conclut que
« la richesse des propositions morphologiques et moléculaires concurrentes [des] phylogénies dominantes des ordres de mammifères réduirait [l’arbre à mammifères] à un buisson non résolu, la seule [relation évolutive] cohérente étant probablement le regroupement des éléphants et des lamatins115. »
En raison de ces conflits, un important article de synthèse paru dans Nature a rapporté que « les disparités entre les arbres moléculaires et morphologiques » conduisent à des « guerres de l’évolution » parce que « les arbres évolutifs construits via l’étude des molécules biologiques ne ressemblent souvent pas à ceux issus de la morphologie116. »
Enfin, une étude publiée dans Science en 2005 tenta d’utiliser les gènes pour reconstruire les relations entre les phyla animaux, mais conclut que « malgré la quantité de données et l’étendue des taxa analysés, les relations entre la plupart des phyla [animaux] restent non résolues ». L’année suivante, les mêmes auteurs publièrent un article scientifique intitulé « Bushes on the Tree of Life » (Des buissons dans l’arbre de la vie), qui présentait des conclusions frappantes. Les auteurs reconnaissent qu' »une grande partie des gènes individuels produisent des phylogénies de mauvaise qualité », observant qu’une étude « a omis 35 % des gènes individuels de leur matrice de données, parce que ces gènes produisaient des phylogénies en contradiction avec les idées reçues. » L’article suggère que « certaines parties critiques de l’arbre de la vie peuvent être difficiles à résoudre, quelle que soit la quantité de données conventionnelles disponibles. » L’article soutient même que « la découverte récurrente de clades (buissons) non résolus de manière persistante devrait forcer une réévaluation de plusieurs hypothèses largement répandues de la systématique moléculaire117. »
Malheureusement, une hypothèse que ces biologistes évolutionnistes ne sont pas prêts à réévaluer est celle de l’ascendance commune universelle. Ils font appel à une myriade d’arguments ad hoc – transfert horizontal de gènes, attraction de longues branches, évolution rapide, différents taux d’évolution, théorie de la coalescence, échantillonnage incomplet, méthodologie défectueuse et évolution convergente – pour expliquer des données dérangeantes qui ne correspondent pas au modèle convoité en forme d’arbre. Comme l’indique un article de 2012, « le conflit phylogénétique est courant et constitue souvent la norme plutôt que l’exception118. » En fin de compte, le rêve que les données sur les séquences d’ADN puissent s’intégrer dans un arbre de la vie de manière parfaite s’est soldé en échec, et avec lui une prédiction clé de la théorie néodarwinienne.
L’article original en anglais a été publié sur Evolution News à l’adresse https://www.discovery.org/a/24041/#fn142 le 20 février 2015 et a été traduit en français et republié sur Bible & Science Diffusion avec autorisation.
Références :
99 Zuckerkandl et Pauling, « Evolutionary Divergence and Convergence in Proteins », 101.
100 Jeffrey H. Schwartz, Bruno Maresca, « Do Molecular Clocks Run at All? A Critique of Molecular Systematics », Biological Theory, 1(4):357-371, (2006.)
101 Ibid.
102 Graham Lawton, « Why Darwin was wrong about the tree of life », New Scientist (21 janvier 2009.)
103 W. Ford Doolittle, « Phylogenetic Classification and the Universal Tree », Science, 284:2124-2128 (25 juin 1999.)
104 Citant en partie Eric Bapteste, dans Lawton, « Why Darwin was wrong about the tree of life » (citations internes omises.)
105 Carl Woese, « The Universal Ancestor », Proceedings of the National Academy of Sciences of the United States, 95:6854-9859 (juin 1998) (c’est nous qui soulignons.)
106 Graham Lawton, « Why Darwin was wrong about the tree of life », New Scientist (21 janvier 2009.)
107 Citant en partie Michael Syvanen, dans Lawton, « Why Darwin was wrong about the tree of life » (citations internes omises.)
108 Michael Syvanen, cité dans Lawton, « Why Darwin was wrong about the tree of life » (citations internes omises.)
109 James H. Degnan et Noah A. Rosenberg, « Gene tree discordance, phylogenetic inference and the multispecies coalescent », Trends in Ecology and Evolution, 24 (2009):332-340.
110 Arcady R. Mushegian, James R. Garey, Jason Martin et Leo X. Liu, « Large-Scale Taxonomic Profiling of Eukaryotic Model Organisms: A Comparison of Orthologous Proteins Encoded by the Human, Fly, Nematode, and Yeast Genomes », Genome Research, 8 (1998):590-598.
111 Elie Dolgin, « Rewriting Evolution », Nature, 486:460-462 (28 juin 2012.)
112 Liliana M. Dávalos, Andrea L. Cirranello, Jonathan H. Geisler et Nancy B. Simmons, « Understanding phylogenetic incongruence : lessons from phyllostomid bats », Biological Reviews of the Cambridge Philosophical Society, 87:991-1024 (2012).
113 Voir par exemple BSCS Biology : A Molecular Approach (Glencoe/McGraw Hill, 2006), 227 ; Sylvia S. Mader, Jeffrey A. Isaacson, Kimberly G. Lyle-Ippolito, Andrew T. Storfer, Inquiry Into Life, 13e éd. (McGraw Hill, 2011), 550.
114 Voir Mchael S. Y. Lee, « Molecular Phylogenies Become Functional », Trends in Ecology and Evolution, 14:177 (1999.)
115 W. W. De Jong, « Molecules remodel the mammalian tree », Trends in Ecology and Evolution, 13(7), pp. 270-274 (7 juillet 1998.)
116 Trisha Gura, « Bones, Molecules or Both ? », Nature, 406 (20 juillet 2000):230-233.
117 Antonis Rokas & Sean B. Carroll, « Bush in the Tree of Life », PLoS Biology, 4(11):1899-1904 (nov. 2006) (citations internes et chiffres omis.)
118 Liliana M. Dávalos, Andrea L. Cirranello, Jonathan H. Geisler et Nancy B. Simmons, « Understanding phylogenetic incongruence: lessons from phyllostomid bats », Biological Reviews of the Cambridge Philosophical Society, 87:991-1024 (2012.)
A propos de Casey Luskin

Casey Luskin
Casey Luskin est scientifique et avocat, et titulaire de diplômes d’études supérieures en sciences et en droit. Il a obtenu une licence et une maîtrise en sciences de la terre à l’université de Californie à San Diego, où il a beaucoup étudié la géologie et l’évolution, tant au niveau du premier que du deuxième cycles. Sa thèse de maîtrise portait sur le paléomagnétisme de la plaine de la rivière Snake dans le Sud de l’Idaho.
Depuis 2005, il est avocat agréé en Californie, après avoir obtenu un diplôme de droit à la faculté de droit de l’université de San Diego, où ses études ont porté sur le droit du Premier amendement de la Constitution, le droit de l’éducation et le droit de l’environnement. Il a également mené des recherches géologiques à la Scripps Institution for Oceanography.
En 2001, il a cofondé le centre IDEA (Intelligent Design and Evolution Awareness), une organisation à but non lucratif qui aide les étudiants dans leurs recherches sur le dessein intelligent (ID) en créant des « clubs IDEA » sur les campus des universités et des lycées du monde entier.
De 2005 à 2015, il a travaillé pour le Centre pour la science et la culture du Discovery Institute, d’abord comme responsable de programme en politique publique et affaires juridiques (2005-2010), puis comme coordinateur de recherche (2011-2015.) Dans ces fonctions, il a aidé et défendu des scientifiques, des éducateurs et des étudiants qui cherchaient à étudier, effectuer des recherches et enseigner librement sur le débat scientifique concernant l’évolution et l’identité néodarwiniennes. Comme expliqué sur son site personnel, au 31 décembre 2015, il ne travaille plus comme membre du personnel du Discovery Institute car il a pour objectif de poursuivre ses études.
Certaines de ses publications sont parues dans des revues techniques de droit et de sciences et dans d’autres revues spécialisées, notamment le Journal of Church and State ; la Montana Law Review ; la Hamline Law Review ; la Liberty University Law Review ; la University of St. Thomas Journal of Law & Public Policy ; et Geochemistry, Geophysics, and Geosystems (G3.) Il a également coécrit ou contribué à de nombreux ouvrages.
Il s’intéresse tout particulièrement à la géologie, à l’enseignement des sciences, aux origines biologiques et à la protection de l’environnement.
Formation :
- Doctorat en droit, Université de San Diego.
- Maîtrise en sciences de la terre, Université de Californie, San Diego.
- Licence en sciences de la terre, université de Californie, San Diego.
Affiliations professionnelles passées et/ou présentes :
- Barreau de Californie.
- Association américaine pour l’avancement de la science.
- Association du barreau américain.
- Union géophysique américaine.
- Société scientifique chrétienne.
- Société juridique chrétienne.
- American Scientific Affiliation.
[…] Problème n° 6 : La biologie moléculaire n’a pas réussi à produire un grand “arbre de la vie…. […]